低级别脑胶质瘤诊断、手术、放化疗的争议?一文详看较新进展
发布时间:2021-06-01 10:55:55 | 阅读:次| 关键词:
- [案例]脑海绵状血管瘤“吃透”的中脑,脑干出血急送ICU的她如
- [案例]“虽小,却危及性命” 脑干海绵状血管瘤出血成功手术重
- [案例]视路胶质瘤治疗陷困局:近失明患者该如何突破“切不净
- [案例]北美可能再也没有比SickKids更好的儿童医院了
- [案例]国际颅底教授“零并发症”全切较大颅咽管瘤,35岁精英重
- [案例]6岁男孩车祸“撞出”脑肿瘤,为何“因祸得福”?
胶质瘤是较常见的脑瘤,按恶性程度分低级别胶质瘤和高级别胶质瘤。低级别胶质瘤(low-grade glioma,LGG)是一类不常见的、WHO分类为I和II级的、原发的中枢神经系统肿瘤。通常处于非活动状态,但是不少肿瘤较终会演变成致命性的高级别胶质瘤。由于此类肿瘤具有漫长的无症状自然史,对那些病灶局限、症状不多的病人,到底是给予的还是延迟的治疗;以及术后放疗和化疗的时机等均存在争议。那患者在咨询过程中有哪些要注意的呢?
一、概述
低级别脑胶质瘤主要指弥漫性星形细胞瘤、少突胶质细胞瘤、少突 星形细胞瘤3种。其他不同类型还包括毛细胞型星形细胞瘤(WHO Ⅰ 级)、室管膜下巨细胞型星形细胞瘤(WHO Ⅰ级)、多形性黄色星形 细胞瘤(pleomorphic xanthoastrocytoma,PXA,WHO Ⅱ级)等。由于 Ⅰ级胶质瘤少见以及其完全不同于Ⅱ级胶质瘤的生物学特性,故本章仅 介绍主要的弥漫性星形细胞瘤和少突胶质细胞瘤。
二、诊断与评估
(一)低级别脑胶质瘤的分子病理分型
以弥漫性星形细胞瘤和少突胶质细胞瘤为主的低级别脑胶质瘤占颅 内原发肿瘤的5%,占脑胶质瘤的40%。自从2016版WHO中枢神经系统 肿瘤新的分类标准发布以来,低级别脑胶质瘤的咨询策略已经发生了重 大的变革(表2-1)。传统的组织病理学分类(主要为星形细胞瘤和少 突胶质细胞瘤)已转变成以若干分子特征为表型的分子病理学分类,包 括以IDH突变、ATRX缺失、TP53突变、无1p/19q联合缺失为分子特征的 星形细胞瘤,和以IDH突变、TERT启动子突变、1p/19q联合缺失为分子 特征的少突胶质细胞瘤。
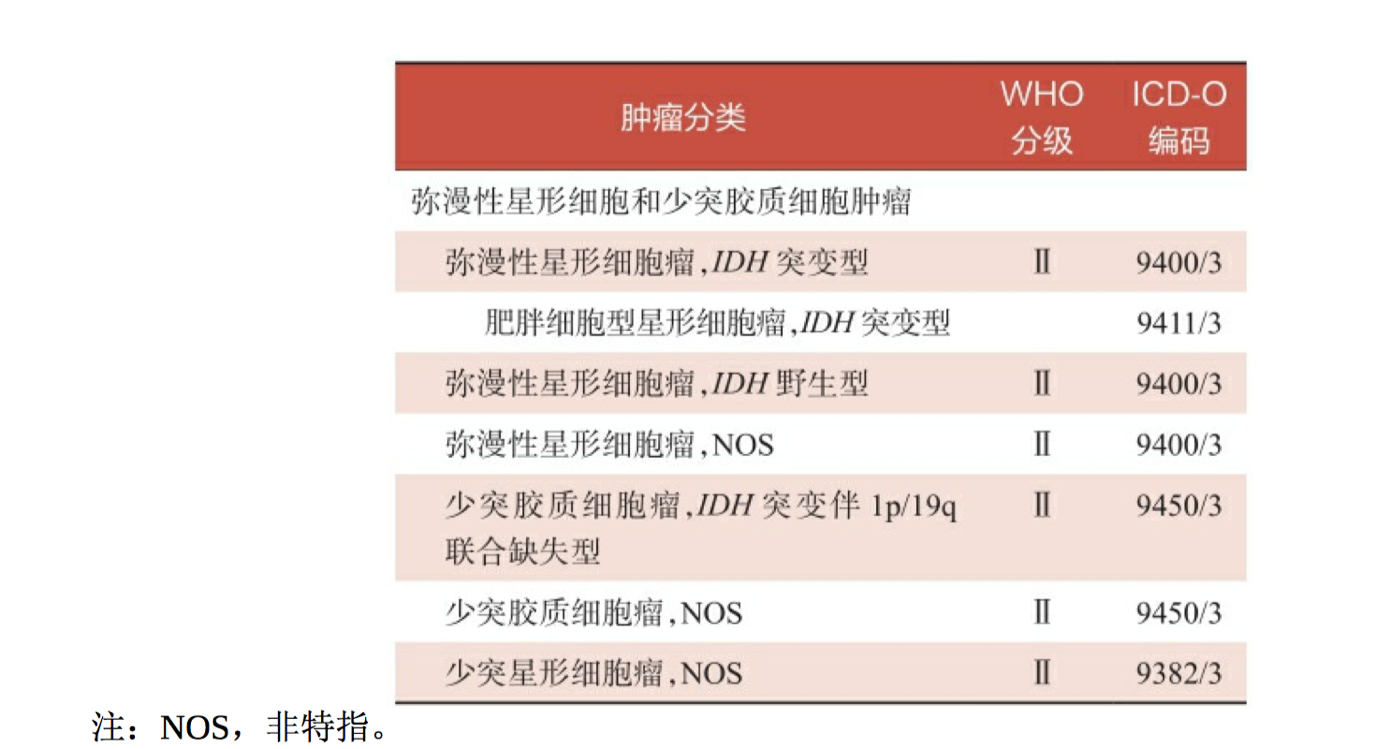
表2-1 2016版WHO中枢神经系统肿瘤分类标准——低级别脑胶质瘤的种类
低级别脑胶质瘤的分子病理诊断流程见图2-1:先通过免疫组 化检测ATRX和IDH1 R132H-突变(代表90%的IDH突变情况),如果 IDH1免疫组化是阳性,可进行1p/19q杂合性缺失检测;如果IDH1免疫 组化是阴性,需行IDH测序检测,以防止IDH2突变漏诊。进而,弥漫性 星形细胞瘤分为IDH突变、IDH野生和NOS三种类型,少突胶质细胞瘤 分为IDH突变伴1p/19q联合缺失型和NOS两种类型。NOS表示非特指, 主要指没有足够的信息分类到更特定病种的肿瘤,该分类不仅包括没有 进行相关基因检测的肿瘤,还包括一小部分虽然进行了基因检测,但是没有发现与诊断相关的基因型改变的肿瘤。
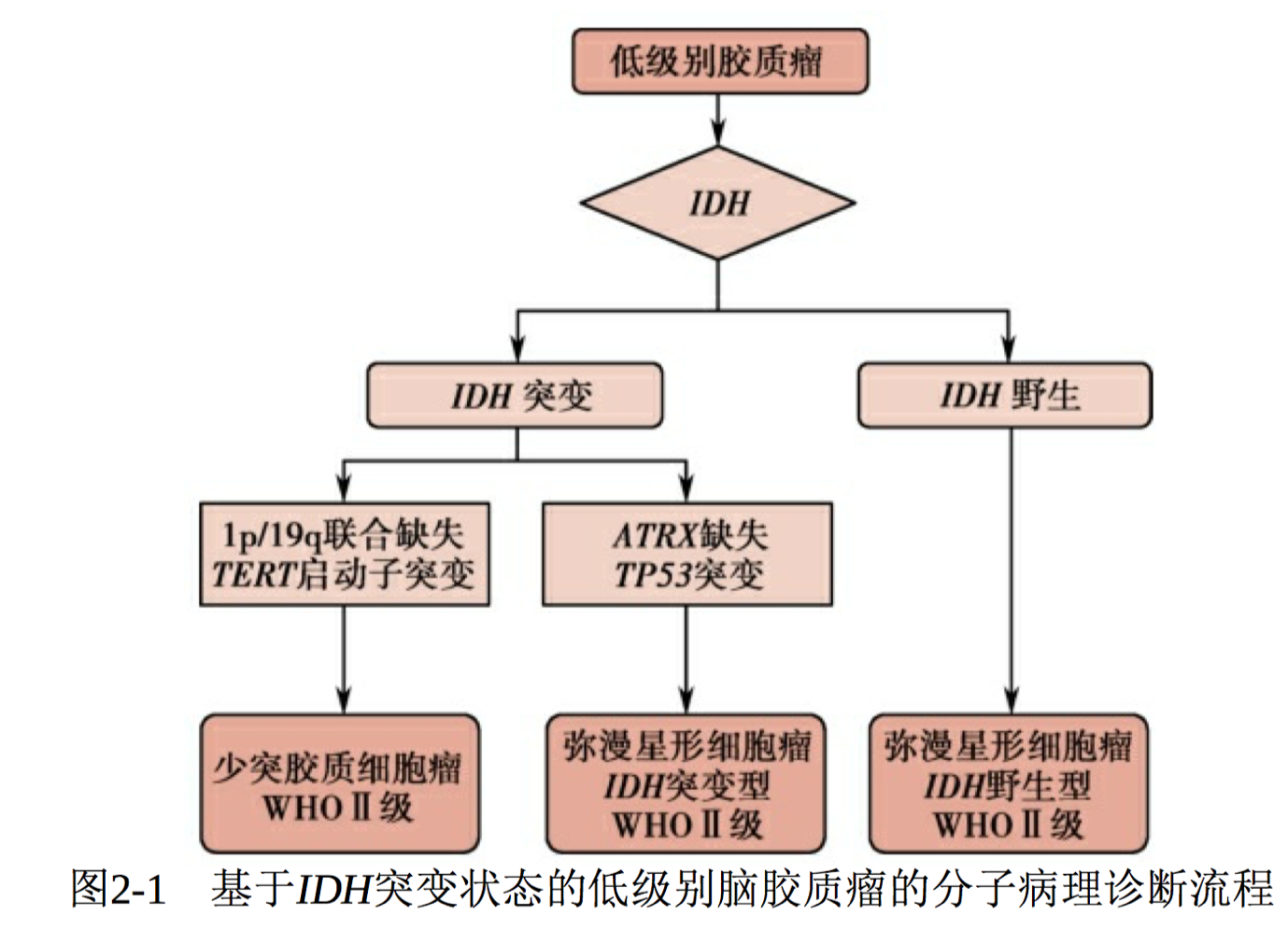
图2-1 基于IDH突变状态的低级别脑胶质瘤的分子病理诊断流程 通过以IDH突变状态为分子基础的低级别脑胶质瘤分型,已经发现 IDH突变在低级别脑胶质瘤预后判断中的作用。IDH野生型的弥漫性星 形细胞瘤具有接近高级别脑胶质瘤的不良预后和较短的生存期;而IDH 突变型的WHO Ⅲ级星形细胞瘤则预后较好,有与WHO Ⅱ级星形细胞 瘤接近的生存期。
(二)常规影像和多模态影像在低级别脑胶质瘤咨询中的应用
常规影像检查主要包括颅脑CT和MRI。CT主要显示脑胶质瘤病变 组织与正常脑组织的密度差值,特征性密度表现如钙化、出血及囊性变 等,病变累及的部位,水肿状况及占位效应等。常规MRI在图像信息上 要优于CT,主要显示脑胶质瘤出血、坏死、水肿组织等的不同信号强 度差异及占位效应,并且可以显示病变的侵袭范围。低级别脑胶质瘤的 MRI信号相对均匀,长T1 、长T2 和FLAIR高信号,边界不清,周边轻度 水肿影,局部轻度占位征象,如邻近脑室可致其轻度受压,中线移位不 明显,脑池基本正常,病变区域内少见出血、坏死及囊变等表现。多模 态MRI包括MR波谱(MRS)、弥散(DWI)及灌注(PWI)成像,不 仅能反映脑胶质瘤的形态学特征,还可以体现肿瘤组织的功能及代谢状 况。DWI高信号区域提示细胞密度大,代表高级别病变区;PWI高灌注 区域提示血容量增多,多为高级别病变区;MRS中胆碱(Cho)峰和 Cho/N-乙酰天门冬氨酸(NAA)升高,与肿瘤级别正相关(图2-2)。 需要注意的是,某些低级别脑胶质瘤在多模态影像上的异常是不明显 的。
一般情况下,星形细胞瘤通常都是在白质内生长,只有到了后期才 累及皮质,而少突胶质细胞瘤则多以皮质累及为主,还常伴钙化。影像 上的强化特征一般被认为是高级别脑胶质瘤恶性及侵袭性的表现,但在 低级别脑胶质瘤中,仍有20%左右存在不同程度的强化,这与血脑屏障 的通透性改变有关。
术前了解肿瘤周围的功能区以及纤维束情况,多依靠功能磁共振成 像(fMRI)和弥散张量成像(DTI)。fMRI是基于大脑进行某项活动时 局部脑区血氧水平的变化,即血氧水平依赖(BOLD)信号,来观察进 行某项任务时的所谓“脑激活”情况。利用fMRI可以在脑肿瘤切除术前无 创地进行脑皮质功能区的定位,为神经外科医师制定较优化的手术方案 提供准确的信息,从而较大水平地切除病灶,较大限度地减少对邻近重 要功能皮质的损伤,进而避免正常功能的丧失,并对手术风险进行准确 的评估。
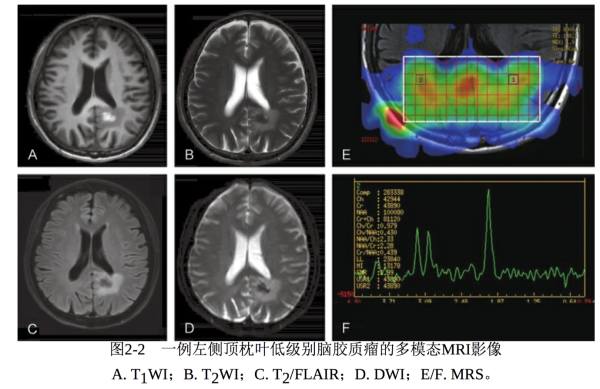
图2-2 一例左侧顶枕叶低级别脑胶质瘤的多模态MRI影像 A. T 1 WI;B. T 2 WI;C. T 2 /FLAIR;D. DWI;E/F. MRS。
基于磁共振的DTI可提示肿瘤与重要纤维束的毗邻关系。应用术前 DTI技术可以提高肿瘤的切除范围,同时保护患者的神经功能。在 非功能区脑胶质瘤患者中广泛应用该技术,以了解肿瘤与周围神经纤维 解剖结构的情况。目前,DTI技术常用来检查的白质纤维包括投射纤维 (皮质脊髓束、皮质脑干束和丘脑辐射)、联络纤维(上、下纵束,下 额枕束)和联合纤维(胼胝体)(图 2-3)。
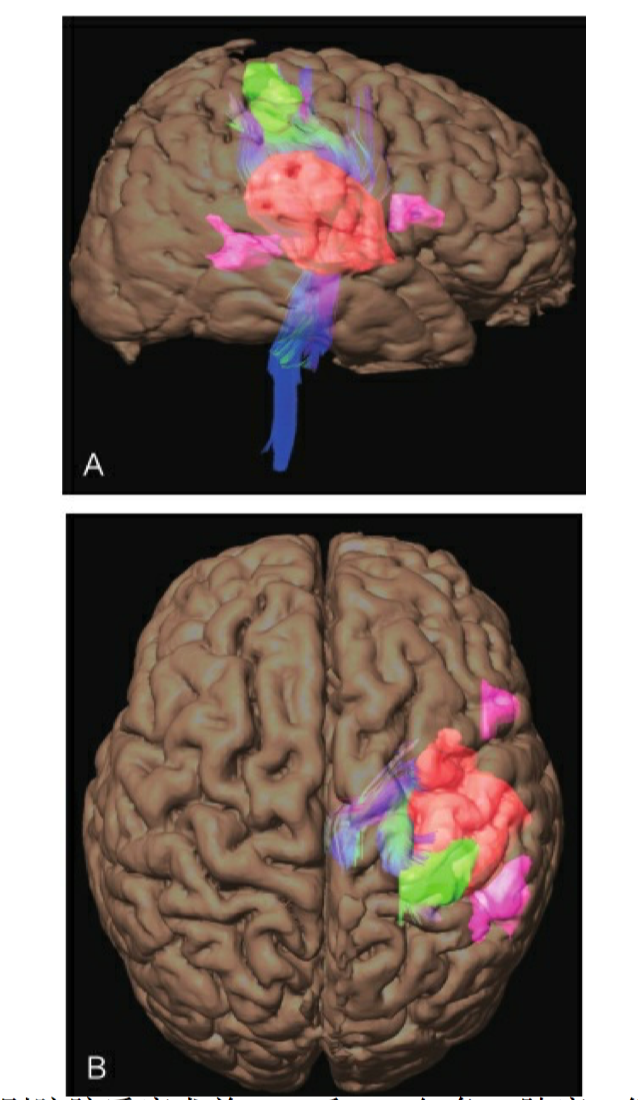
图2-3 一例左侧岛叶低级别脑胶质瘤术前fMRI和DTI红色,肿瘤;绿色,手运动区;紫色,语 言区;蓝色,锥体束。
神经影像诊断在低级别脑胶质瘤咨询中的应用流程如下:首先,进 行定位诊断,确定肿瘤的大小、范围、肿瘤与周围重要结构(包括重要 动脉、皮质静脉、皮质功能区及神经纤维束等)的毗邻关系及形态学特 征等,这对制定脑胶质瘤手术方案具有重要的作用;其次,对神经影像 学提出功能状况的诊断要求,如肿瘤生长代谢、血供状态及肿瘤对周边 脑组织侵袭程度等,这对患者术后的综合疗效评估具有关键作用。多模 态MRI可提供肿瘤的血流动力学、代谢、神经纤维组织受累状况和皮质 功能区等信息,对于脑胶质瘤的鉴别诊断、确定手术边界、预后判断、 监测治疗效果及明确有没有复发等具有重要意义,是形态成像诊断的一个 重要补充。
三、手术治疗
手术是低级别脑胶质瘤的首要及主要的治疗手段。相对于高级别脑 胶质瘤,手术治疗低级别脑胶质瘤的策略包括:全切除甚至超全切除 (超全切除是指切除肿瘤范围以MRI T2 像或FLAIR像做切除边界)非功 能区脑胶质瘤;较大顺利范围切除功能区脑胶质瘤;以诊断为目的肿瘤 部分切除/活检。
(一)低级别脑胶质瘤的手术切除与活检
虽然部分切除或者活检是手术治疗的一种方式,但需要明确的是手 术切除程度与疾病预后密切相关。低级别脑胶质瘤中,肿瘤全切除或次 全切除优于部分切除或活检,全切除或次全切除不仅能延长在患者生存 期,还能降低胶质瘤进展发生的概率。一项1 097例低级别脑胶质瘤患 者的回顾性研究发现,切除程度低于50%与切除程度50%~99%,中位生 存期分别为10.5年和14年,而全切除的患者,中位生存期超过了15年。
如果术前考虑切除程度不足50%,则可以选择活检。大脑深部 是脑干区域的小病灶,广泛弥漫,多发病灶,或者有开颅手术的禁忌 证,都可以考虑活检。常见的活检方式包括立体定向或导航下活检和开 颅手术活检。
(二)低级别脑胶质瘤手术辅助技术的应用
低级别脑胶质瘤的手术辅助技术包括神经导航、术中超声、术中 MRI、唤醒手术以及脑功能定位(brain mapping)等。前三种技术用于 确定肿瘤范围,确保较大范围切除;后两种技术则是为了保护运动和语 言等重要脑功能。
将术前得到的结构图像信息融入神经导航,完成参考架及参考点的 注册,随后在神经导航的辅助下标出病变的体表投影,适当调整切口。 术中可根据导航探针的位置确定手术切除的位置及切除深度。术中MRI 技术可以提高低级别脑胶质瘤的切除程度,辅助术者确定肿瘤切除后残 余肿瘤的体积,明确肿瘤的切除程度。由于术中MRI技术逐渐被推广, 所以强烈对于非功能区低级别脑胶质瘤患者使用术中MRI技术辅助 肿瘤切除。术中超声具有操作简便、实时性好等特点,不仅能实时对病 灶进行定位,辅助术者判断其切除程度,同时还能提供病灶周围及内部 的血流情况,对识别肿瘤边界有帮助;其缺点是图像易受切面、空 气、水肿带等影响(图2-4)。
对功能区脑胶质瘤患者采用术中唤醒配合术中皮质及皮质下电刺激 进行功能区定位被认为是判断脑功能区的金标准。术中对运动功能、语 言功能、空间忽视、视野进行皮质电刺激监测可合适保护患者相应的功 能,在提高肿瘤切除程度的同时合适避免患者出现术后长期性功能障 碍。唤醒手术适用于胶质瘤位于功能区,是语言区,且能够理解并 能配合唤醒手术的患者。低龄患者(<18岁)、认知障碍以及严重高颅 压是应用术中唤醒的禁忌证。具体麻醉及手术操作流程详见四章“功 能区脑胶质瘤的临床管理”。
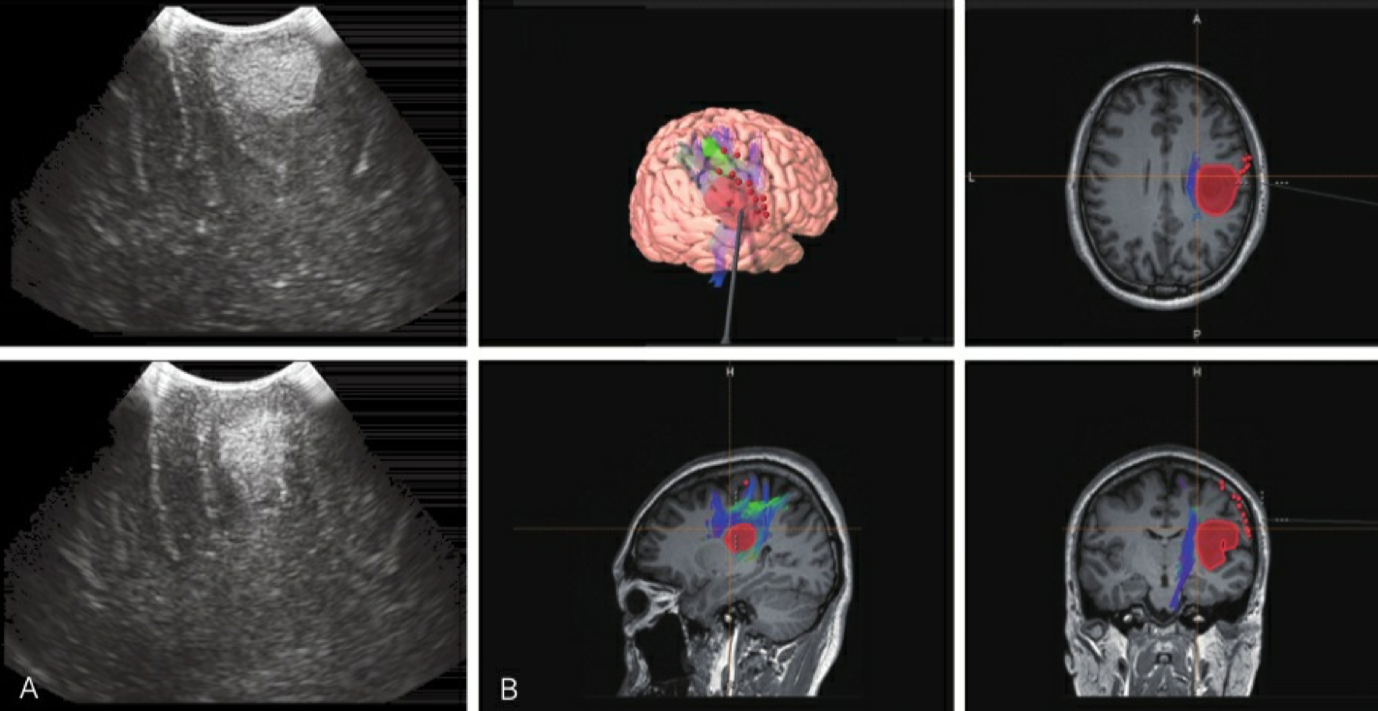
图2-4 一例左侧优势半球低级别岛叶脑胶质瘤唤醒麻醉及脑功能定位下手术切除,术中超声及 MRI技术辅助判断切除程度 A.术中超声;B. MRI术中导航。
(三)低级别脑胶质瘤手术切除后评价
低级别脑胶质瘤的手术切除后评价包括肿瘤切除程度的评价、术后 神经功能的评价以及术后随访的评价。
对于低级别脑胶质瘤切除程度的评估,建议根据术后72h内MRI T2 /FLAIR像与术前T2 /FLAIR像相比肿瘤体积的变化确定肿瘤的切除程 度。以往习惯将切除程度按切除肿瘤体积分为4个等级:全切除、次全 切除、部分切除及活检。虽然不同研究对于这4个等级的具体定义并不 统一,但全切除(全切切除)相比未全切除(低于全切),对患者预 后和生存期是有影响的。
随访建议在术后1年内每3个月进行MRI检查,2年内每半年进 行,病情有变化随时进行相应的影像学检查。影像学评价建议采用神经 肿瘤临床疗效评价(response assessment in neuro-oncology,RANO)标 准,可以只用T2 /FLAIR像进行低级别脑胶质瘤的治疗效果评价,如果出 现新发病灶,建议使用T1 增强像,以判断肿瘤是否向高级别进展。
患者术后神经功能评价包括Karnofsky功能状态(Karnofsky performance status,KPS)评分、语言功能、运动功能及生活质量状态 等。评价过程采用神经影像与行为量表相结合的方式。常用的行为 量表包括西部失语症检查(WAB)、蒙特利尔认知评估(MoCA)量 表、抑郁自评量表(SDS)、焦虑自评量表(SAS)等。
(四)手术时机——偶然发现的胶质瘤的手术治疗
随着头部影像学检查的广泛开展,越来越多的小病灶(可疑胶质 瘤)被影像诊断。对于这些偶然发现的胶质瘤(incidental glioma),多 数是早期的小灶的低级别脑胶质瘤,尚无临床症状,是否立即手术目前 还没有明确的定论。主流的观点有三种:①密切观察,如果病变有变化 进展,立即手术(wait and see);②美国加州大学旧金山分校 (UCSF)的专家认为,可以根据现有的影像资料,特别是多模态影 像,判断病变恶性程度或进展的可能性大小,来决定是否手术(a tailored screening);③法国Hugues Duffau教授认为,对于偶然发现的 可能为胶质瘤的小病灶,应该采取预防性手术切除(preventive neurooncological surgery)。
可以肯定的是,在病灶小的时候早期手术,不仅可以扩大切除范 围,也有利于脑功能保护,好转临床预后和生存期,还可以防止病灶长 大后的肿瘤级别进展。
(五)合并癫痫的低级别脑胶质瘤手术
癫痫是低级别脑胶质瘤患者较常见的临床表现,占全部低级别脑胶 质瘤患者的65%~90%,一般从症状出现到临床确诊的时间在6~17个 月。胶质瘤患者术前进行癫痫症状评估对制定手术方案及评估患者预后 具有重要意义。围手术期要对患者的癫痫史、癫痫发作的症状、癫痫发 作程度及药物控制这四个方面进行客观评估。对低级别脑胶质瘤患者行 手术切除治疗,可合适控制患者伴发的癫痫症状。与次全切除、部分切 除及活检相比,肿瘤全切除对控制或好转患者的癫痫症状往往有较好的 效果。根据Engel分级,肿瘤全切除对患者癫痫的缓解率分别可达:完 全缓解(Ⅰ级86.4%)、未完全缓解(Ⅱ~Ⅳ级13.6%)。但是,对于肿 瘤累及范围之外可能存在的致痫灶,目前尚无明确的手术处理方案。如 严重影响患者生活质量,病理分子亚型预后良好,可以进行相关的检 查,确定癫痫灶,单纯药物治疗效果不佳,可以考虑再次手术治疗。低 级别脑胶质瘤导致的继发性癫痫,通过术后正规服用抗癫痫药物以及定 期脑电图评估,可以在部分患者实现癫痫治愈的效果。
四、放射治疗
(一)术后辅助治疗的时机
单独的手术治疗不可能完全治愈弥漫性生长的低级别脑胶质瘤,几 乎全部的低级别脑胶质瘤较终都需要应用放射治疗(以下简称“放 疗”)、化学治疗(以下简称“化疗”)等辅助治疗手段。与高级别脑胶 质瘤相比,是胶质母细胞瘤术后应尽早使用放化疗的要求,低级别 脑胶质瘤术后使用辅助治疗的时机目前尚未有明确的规定。另外,低级 别脑胶质瘤术后实施辅助治疗的方案(是单独放疗或单独化疗,还是放 疗联合化疗)目前尚无确定的规范,还在进一步的研究中,但患者的高 危因素是决定是否进行辅助放化疗的考虑因素。
低级别脑胶质瘤的高危因素(影响疾病预后和生存期)包括以下5 项:年龄≥40岁;肿瘤直径≥4cm;肿瘤未全切除;星形细胞瘤成分;无 1p/19q联合缺失。如果具有以上高危因素之一,需要考虑术后立即辅助 治疗。当然上述危险因素的限定还有不确定之处,比如年龄(40岁的分 界点),肿瘤直径[美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南建议为6cm],目前各种临床试验对危险 因素的规定还有具体的差别。美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)一项关于低级别脑胶质瘤的临床试验 (RTOG 9802)中,111名低危因素的患者(年龄<40岁,肿瘤全切除) 仅进行术后观察,不给予辅助治疗,2年的总体生存率达到99%,5年的 总体生存率达到93%,但是其中有52%的患者在5年出现疾病进展。因 此对低级别脑胶质瘤术后是否给予辅助治疗,具有哪些低危因素的患者 可以观察,需要持谨慎态度。
本指南针对低级别脑胶质瘤术后给予辅助治疗的建议如下:①年轻 患者(≤40岁),肿瘤全切除,并且肿瘤组织类型为少突胶质细胞瘤 (IDH突变以及1p/19q联合缺失),可以观察治疗,观察期间发现疾病 进展再给予辅助治疗。②老年患者,肿瘤未全切除,且具有1个以上危 险因素,建议术后立即开始辅助治疗。而且,具有的危险因素越多,越 需要立即进行术后辅助治疗,需要更多的辅助治疗方式(比如放疗联合 化疗)。
(二)放疗剂量:关于低级别脑胶质瘤放疗剂量的前瞻性随机对照研究结果提示,高 剂量放疗未带来明显生存获益。因此,常规建议术后放疗总剂量为 45.0~54.0Gy,单次剂量1.8~2.0Gy,残留病灶的放疗剂量>50.0Gy。
(三)靶区勾画:低级别脑胶质瘤切除程度的判定主要依据MRI T2 或FLAIR高信号影像,应与术前影像比较,以排除由手术创伤所致的异常信号干扰,从而 判断肿瘤是否全切除,并以此作为勾画大体肿瘤靶区(gross target volume,GTV)的依据。应用11 C-蛋氨酸(MET) -正电子发射计算机 体层显像(PET/CT)、多模态MRI等功能影像学技术,有助于确定低 级别脑胶质瘤术后残留肿瘤的范围和监测治疗后反应。有条件的机构可 选择性将MRI与功能影像学新技术相结合,更好地判断低级别脑胶质瘤 的实际肿瘤边界、术后残留及肿瘤浸润等情况。
依据术前和术后的MRI影像,采用FLAIR序列和T2 序列中长信号的区域定义为GTV;在GTV外放1~2cm 作为临床靶区(clinical target volume,CTV);超出解剖屏障的部分可仅包括0.5cm的解剖屏障外的 结构;对于弥漫多病灶的低级别脑胶质瘤,建议在放疗45.0Gy左右时复查MRI,残留病灶周围外放1cm,加量至54.0Gy。
肿瘤侵犯脑室的低级别脑胶质瘤,建议靶区勾画与其他部位的低级 别脑胶质瘤相同。低级别脑胶质瘤术后较大残腔的靶区勾画,整个 残腔作为GTV的一部分。囊性肿瘤占位效应较大,常挤压周围脑组织, 行手术切除后形成较小残腔,强调根据术后放疗前MRI和CT模拟显示的 残腔勾画GTV,不需要包括全部术前囊腔的范围。
五、药物治疗
由于脑胶质瘤的侵袭性生长特性及解剖位置的不同性,尽管采取手 术和放疗,仍难免复发,药物治疗对进一步杀灭残存胶质瘤细胞发挥重 要的作用。手术、放疗联合药物治疗的综合治疗是目前提高脑胶质瘤疗 效的关键。药物治疗胶质瘤的优势在于:手术和放疗都是局部治疗,而 药物治疗是全身治疗,对手术和放疗作用不到的、潜伏着胶质瘤细胞的 脑组织也能发挥治疗作用,可以杀灭侵袭到手术和放疗照射野以外的瘤 细胞,从而减少肿瘤复发;另外,药物治疗可以多次进行,对不能再次 手术及放疗的复发患者,药物治疗是有力的挽救性治疗措施。药物治 疗,除了通常使用的化疗药物外,还包括分子靶向治疗、生物免疫治疗 等,但分子靶向治疗和生物免疫治疗目前均尚在临床试验阶段。应尽量 鼓励有条件及符合条件的患者,在不同疾病阶段参加药物临床试验。
(一)PCV方案:PCV方案是三种药物联合使用,分别是甲基苄肼(procarbazine)、 洛莫司汀(CCNU)以及长春新碱(vincristine)。
RTOG 9802关于PCV方案治疗低级别脑胶质瘤的研究2016年发表 在New England Journal of Medicine,这是一项美国、加拿大、英国等近 20家机构开展的有关PCV化疗低级别脑胶质瘤的多中心随机对照临床研 究。该研究共纳入251例幕上WHO Ⅱ级胶质瘤患者,包括星形细胞瘤、 少突胶质细胞瘤和少突星形细胞瘤。入选患者包括40岁以下肿瘤次全切 除或活检的患者、40岁以上肿瘤不同程度切除的患者。将患者随机分配 至单纯放疗组、放疗+6个疗程的PCV方案化疗组。具体的治疗方案为: 放疗总剂量为54.0Gy,在6周内分30次照射;化疗采用甲基苄肼[60mg/ (m2 ·d),每 个 疗 程 8~21 天使用)],CCNU(110mg/m2 ,每个 疗程 1 天使用),长春新碱(1.4mg/m2 ,较大剂量2.0mg,每个疗程 8天和29天静脉给药),每个疗程时间为8周。研究结果提示全部患 者中位随访时间11.9年,55%在随访期间死亡;放疗+6个疗程的PCV方 案化疗组与单纯放疗组相比,总体生存期明显延长(13.3年 vs. 7.8 年),10年无进展生存率明显提高(51%vs. 21%),10年总体生存率显 著提高(60% vs. 40%)。多因素生存预后分析提示,少突胶质细胞瘤 和放疗+6个疗程的PCV方案化疗是判断无进展生存期和总体生存期预后 良好的因素;IDH突变是有助于延长无进展生存期的独自因素,但对总 体生存期无影响。这项研究中,虽然放疗+6个疗程的PCV方案的骨髓抑 制不良反应较单纯放疗提高,但总体生存率提高了近2倍,该项研究强 有力地支持PCV方案在低级别脑胶质瘤中的应用。
(二)替莫唑胺:虽然RTOG 9802 Ⅲ期临床试验以及长期随访证实了PCV方案在低级 别脑胶质瘤中的作用和地位,但该研究始于1998年,目前单纯的临床因 素已不再是低级别脑胶质瘤患者的分类标准,且新的化疗药物替莫唑胺 (temozolomide,TMZ)具有口服方便、毒性低的特点,已在脑胶质瘤 的治疗中广泛取代了PCV化疗方案。
烷化剂替莫唑胺的发现与应用是近二十年来胶质瘤化疗药物领域的 较大突破。该药为口服制剂,易于通过血脑屏障,与PCV化疗方案相 比,不良反应轻,耐受性好,无积累毒性。RTOG 0424为一项单臂的Ⅱ 期临床试验,对低级别脑胶质瘤患者采取术后放疗联合TMZ化疗的治疗 方式,总共129例具有至少3个以上高危因素(年龄≥40岁、星形细胞、 肿瘤过中线、肿瘤直径≥6cm、术前中重度神经功能缺损)的低级别脑 胶质瘤患者入组,治疗方案为同步放化疗及12个周期替莫唑胺辅助化 疗。治疗后3年生存率为73%,优于历史对照的54%,5年生存率达 到了57.1%。虽然初步结果显示TMZ的治疗效果不及PCV方案,但由于 两个临床试验的纳入标准并不一致,故不能得出孰优孰劣的结论。其 后,有研究者将RTOG 0424研究中这些高危低级别脑胶质瘤进行了 MGMT启动子甲基化检测,结果发现MGMT启动子未甲基化与放化疗后 较差的总生存期(overall survival,OS)和无进展生存期(progressionfree survival,PFS)相关(风险值分别为3.52和3.06),这一结果发 表在2018年的JAMA Oncology。上述结果与IDH突变与否无关,提示在 低级别脑胶质瘤中MGMT启动子甲基化是除了IDH突变以外另一个重要 的判断预后的分子标记物。
另外,有研究者也在考虑替莫唑胺化疗方案是否可以取代低级别脑 胶质瘤患者的术后放疗,但目前也缺少足够的循证医学证据支持。
六、其他治疗
低级别脑胶质瘤的自然病程较高级别脑胶质瘤更长,生存期观察期 长,临床试验往往需要耗时10年甚至20年以上才能得出较终结论。表22是目前低级别脑胶质瘤主要的相关临床试验,包括了对术后观察、术 后单独放疗、术后单独化疗,以及术后放疗联合化疗的临床疗效观察。
表2-2 低级别脑胶质瘤术后辅助治疗相关临床试验汇总
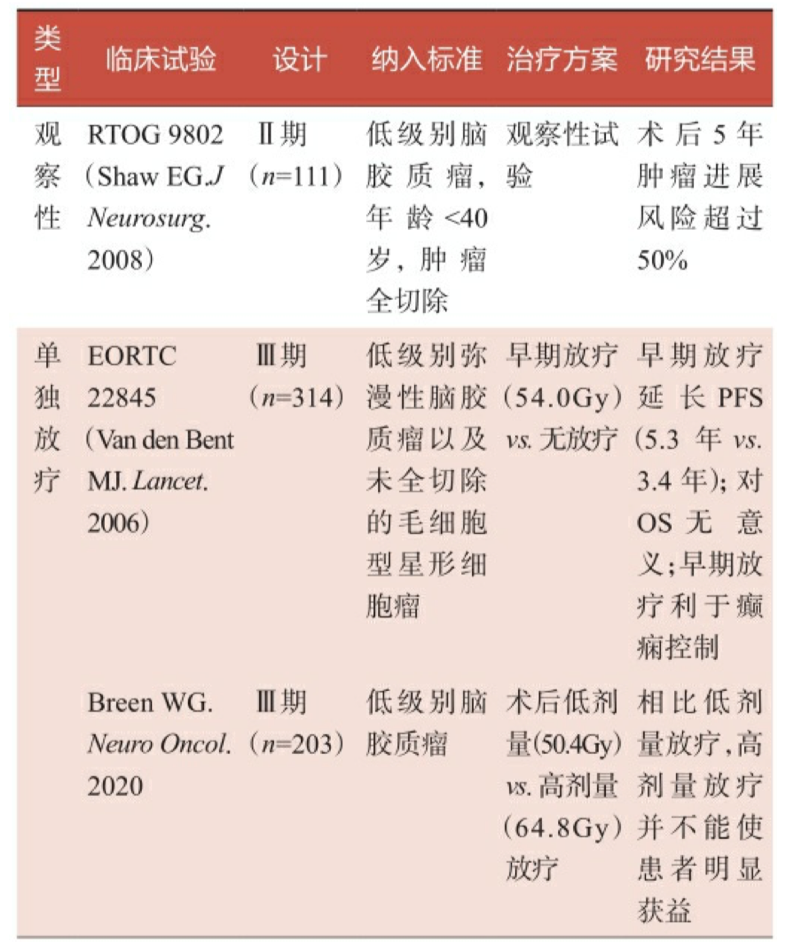
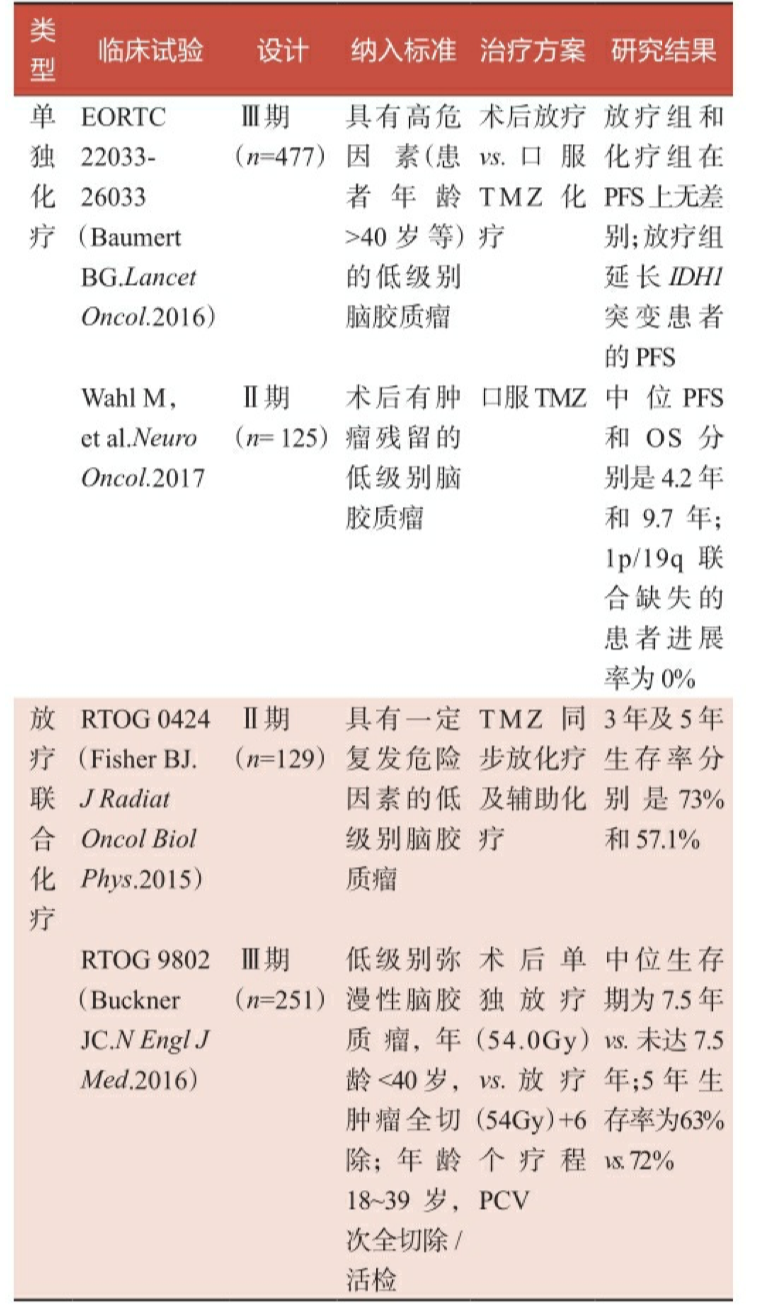
注:PFS,无进展生存期;OS,总生存期;TMZ,替莫唑胺;PCV,甲基苄肼+洛莫司汀+长春 新碱。
低级别脑胶质瘤的咨询流程
如上文所述,低级别脑胶质瘤术后辅助治疗尚缺乏足够的临床试验 支持,未能形成统一的治疗方案,故图2-5中的治疗方案是结合众多国 际上的临床指南以及已有的临床试验结果形成,供临床参考,应用于临 床时仍需根据患者的具体情况进行调整。
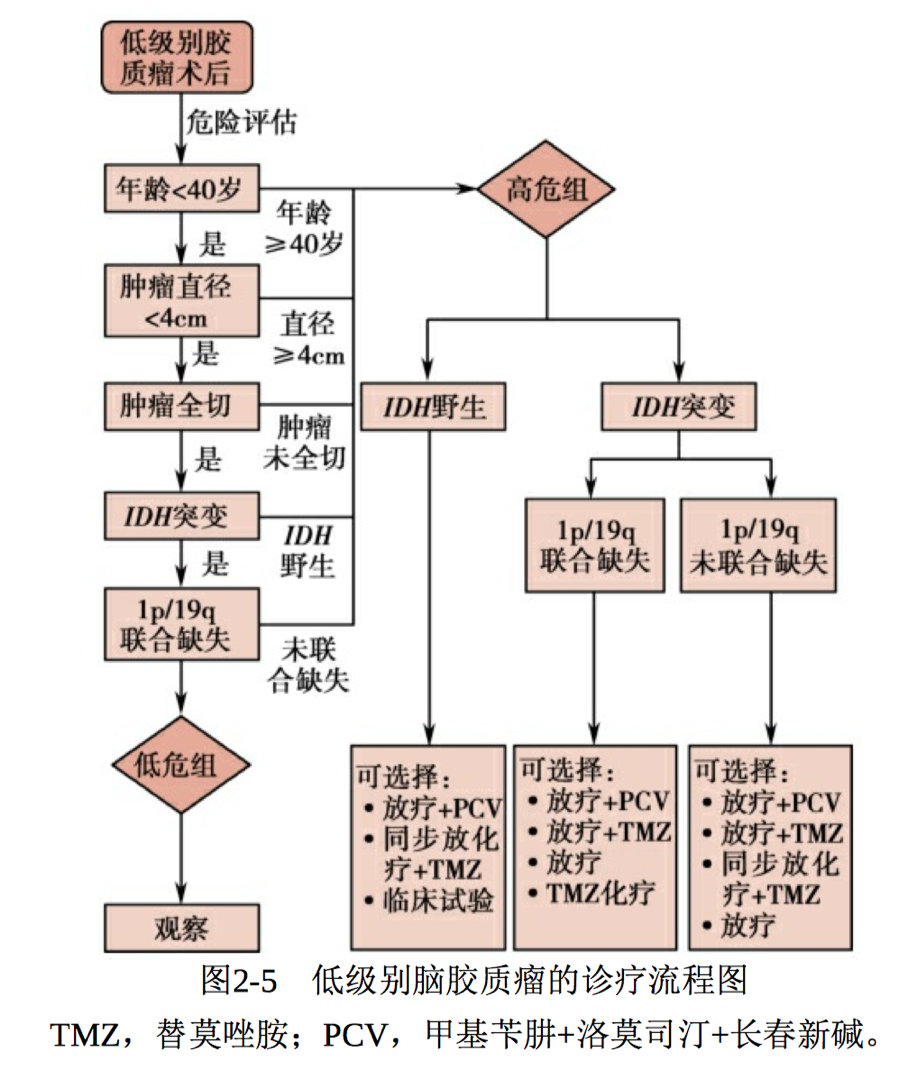
图2-5 低级别脑胶质瘤的咨询流程图
参考文献
[5]国家卫生健康委员会医政医管局.中华神经外科杂志, 2019, 35 (3): 217-239.

- 所属栏目:胶质瘤
- 如想转载“低级别脑胶质瘤诊断、手术、放化疗的争议?一文详看较新进展”请务必注明来源和链接。
- 网址:https://www.incsg.com/jiaozhiliu/840.html
- 更新时间:2021-06-01 10:29:03
- 上一篇:恶性胶质瘤分子靶向治疗的挑战和前景
- 下一篇:小儿低级别胶质瘤能用质子治疗吗?







