儿童脊索瘤的管理与预后:SickKids儿童医院经验及文献综述
发布时间:2025-11-25 10:29:33 | 阅读:次| 关键词:儿童脊索瘤的管理与预后:SickKids 儿童医院经验及文献综述
- [案例]听力下降却发现脑子面听神经旁“长满珍珠”,他如何“
- [案例]INC巴教授1980年代攻克禁区——基底节海绵状血管瘤全切手
- [案例]“想成为像Rutka教授一样的好医生!”曾被他救下的脑瘤女
- [案例]这种脑瘤竟让8岁男孩“穿越时空”,20天快速长高是福是
- [案例]脑干海绵状血管瘤反复出血还有救吗?INC巴特朗菲教授脑
- [案例]这种脑瘤竟会影响孩子生长发育!一个7岁颅咽管瘤患儿的
James T. Rutka(鲁特卡)教授曾担任世界神经外科学院院长,现任世界神经外科专业杂志《Journal of Neurosurgery》主编。三十余年来,他专注于儿童神经外科研究,带领团队在脑瘤分子分型、精准治疗、新药研发及微创技术等领域实现多项突破,为全球神经外科疑难病症患儿带来希望。其发表的研究《Management and outcome of chordomas in the pediatric population: The Hospital for Sick Children experience and review of the literature》对儿童脊索瘤的临床管理进行了系统总结,以下为研究内容简述。
01PART 研究亮点与摘要
脊索瘤为起源于胚胎期脊索残余组织的罕见肿瘤。
研究纳入1987年至2015年间共10例儿童脊索瘤病例进行回顾性分析。
所有患者均接受手术切除治疗,术后辅以放射治疗,部分病例根据病情需要给予化疗。
经典型病理学类型的患者预后良好;而非典型或软骨样病理类型患者预后较差。
脊索瘤是一种源自胚胎脊索残余组织的肿瘤,最常见于蝶枕区、脊柱或骶尾部。该病在儿童中较为罕见,由于肿瘤位置深在、毗邻重要解剖结构且易侵犯周围组织,临床治疗面临巨大挑战。本研究报道了SickKids儿童医院收治的10例儿童脊索瘤病例,重点分析了其手术治疗、辅助治疗策略及长期预后情况。本研究通过回顾性分析1987-2015年期间的病历资料,包括临床记录、影像学资料及病理切片。分析的主要变量包括:患者人口统计学特征、肿瘤位置、临床表现、影像学特点、病理学亚型、治疗方案以及长期随访结果。
本组患者包括7例女孩和3例男孩,肿瘤均位于颅底或颈上段脊柱。其中1例表现为硬膜外左侧小脑桥脑角区脊索瘤,呈现高度侵袭性及去分化特征,据我们所知,此类病例在既往文献中尚未见报道。所有患者均接受了手术切除治疗,术后予以光子或质子放射治疗。其中4例具有软骨样或非典型病理特征的患者还接受了辅助化疗。所有经典型病理类型的患者均获得良好预后,而4例非典型病理患者即使经过积极治疗,病情仍迅速进展,提示病理亚型是影响预后的关键因素。
本研究总结了一家大型学术中心在儿童脊索瘤外科手术与辅助治疗方面三十年的经验。患者结局与病理类型高度相关,治疗应采取多学科综合策略,包括手术切除、放射治疗及个体化化疗方案。
02PART 研究方法
利用SickKids儿童医院神经外科前瞻性维护的数据库,检索1987年1月至2015年1月期间确诊的脊索瘤病例。通过回顾性分析患者病历及影像资料,收集以下信息:年龄、性别、既往病史、临床症状与体征、肿瘤位置、影像学特征、治疗方式及结局。本研究已获得SickKids研究伦理委员会批准。
使用MEDLINE和Embase数据库,以“chordoma(脊索瘤)”和“pediatric(儿童)”作为检索词,筛选英文文献中的病例系列报道,相关文献与数据提取由第一作者及第二作者共同完成。
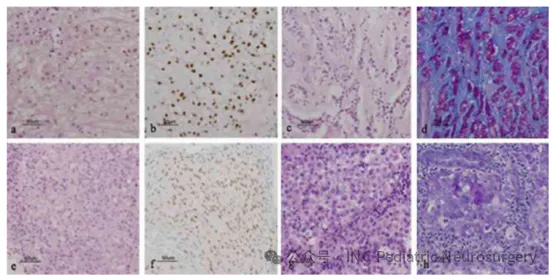
部分患者的病理切片示例如下:
(a)患者2:经典型病理,苏木精-伊红染色(H&E);
(b)患者2:Brachyury免疫组化染色;
(c)患者5:经典型病理伴软骨样特征,H&E染色;
(d)患者5:PAS-AB(过碘酸-Schiff-阿利新蓝)染色;
(e)患者6:非典型病理,H&E染色;
(f)患者6:Brachyury免疫组化染色;
(g)患者10:非典型病理,H&E染色;
(h)患者10:PAS-AB染色。
03PART 典型病例选例
患者2
于2013年就诊,11岁,主诉为颈部和手臂疼痛持续2周。MRI检查显示C1-C3节段大体积侵袭性脊索瘤,伴有明显的右侧外向延伸(图2)。患者在外院接受C3-C5椎板切除术,但因术中体感诱发电位(SSEP)信号丢失,肿瘤切除不完全且手术被迫中止。
转入SickKids儿童医院后,患者接受经右前外侧颈部入路的肿瘤切除术,实现肿瘤全切(gross total resection)。病理诊断为经典型脊索瘤,免疫组化结果显示S100、广谱细胞角蛋白(pan-CK)、CK-19、CK-8、癌胚抗原(CEA)、低分子量细胞角蛋白(LMW-K)、波形蛋白(vimentin)以及EMA均为阳性。
术后随访影像显示右侧存在少量囊性残留病灶,经70Gy光子放疗后得到良好控制。手术及放疗两年后,患者出现颈椎后凸侧弯(cervical kyphoscoliosis)伴颈部疼痛,随后接受C3-T1节段内固定融合术。
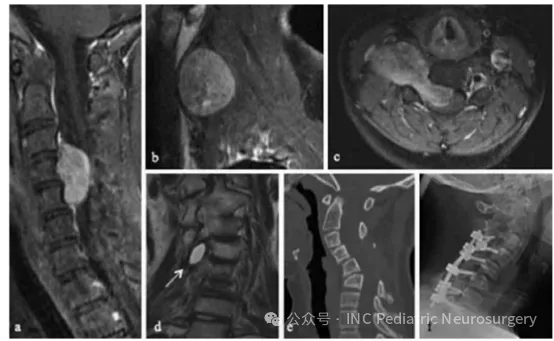
图2. 患者2 C3-C5脊索瘤影像资料
(a)术前矢状位T1加权增强MRI;
(b)术前轴位T1加权增强MRI;
(c)术前矢状位CT;
(d)术后矢状位T1加权增强MRI,显示右侧囊性残留;
(e)术后2年矢状位CT,可见进行性颈椎后凸侧弯(kyphoscoliosis);
(f)术后C3-T1内固定融合侧位X线片。
患者4
患者于2005年就诊,10岁。主诉为持续性颈部疼痛2年,伴有反复咽喉感染及吞咽困难。检查发现C1-C3脊索瘤,并导致上气道受压(图3)。患者首先接受经口活检,随后通过经口、经腭、经下颌联合入路实施肿瘤全切(gross total resection)。病理诊断为经典型脊索瘤。
术后影像显示左侧C2-C3神经孔内仍有残余病灶,经70Gy光子放疗后控制良好。患者对治疗耐受情况良好,术后10年随访无肿瘤复发、无神经功能缺损,保持无瘤状态。
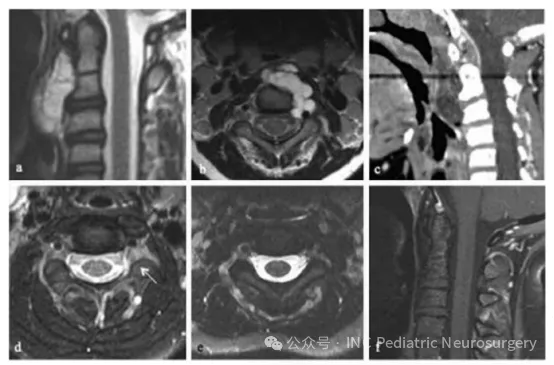
图3. 患者4 C1-C3脊索瘤影像资料
(a)术前矢状位T1加权增强MRI;
(b)术前轴位T1加权增强MRI;
(c)术前矢状位CT;
(d)术后轴位T1加权增强MRI,可见C2-C3神经孔内小残余肿瘤(箭头);
(e)放疗后轴位T1加权增强MRI;
(f)放疗后矢状位T1加权增强MRI。
患者5
患者于2003年就诊,11岁。主诉为下位颅神经功能缺损持续2个月,伴有鼻塞、斜颈(torticollis)以及右足阵挛(clonus)。影像学显示斜坡区巨大破坏性肿块,向左侧延伸,侵犯鼻咽部,并包绕左侧颈内动脉(图4)。患者在经口活检后,接受经口、经腭、经下颌联合入路的部分肿瘤切除术,手术历时13小时,术后行枕骨-C3内固定融合术。病理结果显示为经典型脊索瘤,伴软骨样分化区域,MIB-1增殖指数30-50%,并检测到p53蛋白表达。
尽管接受了光子放疗,患者在诊断10个月后出现肿瘤进展。复发后接受5个月的Trabectedin(抗肿瘤化疗药物)治疗,但病情仍迅速恶化,患者最终于诊断后15个月去世。
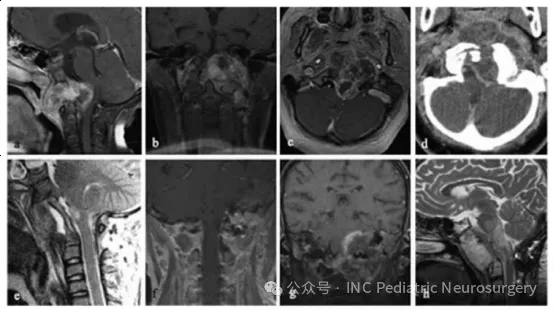
图4. 患者5巨大斜坡脊索瘤伴脑干受压
(a)术前矢状位T1加权增强MRI;
(b)术前冠状位T1加权增强MRI;
(c)术前轴位T1加权增强MRI;
(d)术前轴位CT扫描;
(e)术后矢状位T1加权增强MRI;
(f)术后冠状位T1加权增强MRI;
(g)术后1年冠状位T1加权增强MRI;
(h)术后1年矢状位T2加权MRI。
患者6
患者于2001年就诊,10岁,既往有8个月颈部疼痛和3周左上肢无力及感觉异常的病史。影像学检查发现C1-C3节段脊索瘤(图5)。患者首先行经口活检/部分减压术。病理诊断为不典型组织学类型,随后接受两个周期ICE方案化疗。
活检后40天,患者接受经后正中入路的部分肿瘤切除术,行C1-C3椎板切除及髂骨植骨融合术。术后,患者进一步接受姑息性放疗(在重症监护室期间完成5次分次放疗)及27天低剂量依托泊苷化疗。
然而,肿瘤快速进展,侵犯颈椎及右侧前外方颈部软组织。确诊后4个月决定采取姑息治疗,此后不久患儿去世。
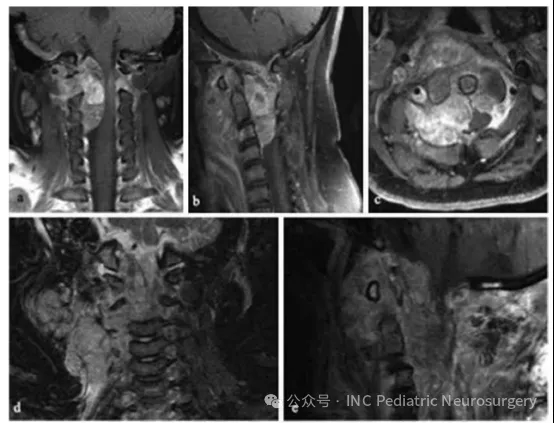
图5. 患者6 C1-C3节段脊索瘤影像资料
(a)术前冠状位T1加权增强MRI;
(b)术前矢状位T1加权增强MRI;
(c)术前轴位T1加权增强MRI;
(d)术后4个月冠状位T1加权增强MRI;
(e)术后4个月矢状位T1加权增强MRI。
患者10
患者于2015年就诊,14个月大,主诉为巨头畸形(macrocephaly)2个月、中央性肌张力低下、声音微弱、吞咽困难,以及发育倒退。检查发现显著交通性脑积水与巨脑症,并伴有左侧小脑桥脑角(CPA)巨大异质性强化病灶,影像学可见出血伪影(blooming artifact)、液-液平面(fluid-fluid levels),且肿瘤压迫脑干(图6)。
患者接受左侧后乙状窦开颅术(retrosigmoid craniectomy)。术中冰冻病理提示淋巴样细胞,仅能行次全切除(subtotal resection),脑干部位仍有肿瘤残留。术后,患者持续存在颅神经功能缺损、吞咽困难(需行胃造口术),以及原因不明的交通性脑积水(需行脑室-腹腔分流术)。
最终石蜡病理结果显示为非典型脊索瘤(atypical chordoma),免疫组化Brachyury、pan-CK、EMA、IN11基因产物(BAF47/IN11)均为阳性。在已报道的儿童脊索瘤病例中,该患者是年龄最小的病例之一,也是唯一发生在CPA区域的病例。
由于患儿年龄极小、肿瘤位置特殊且病理类型为非典型,治疗决策由多学科团队(MDT)制定。她接受了3个周期ICE方案化疗。虽然术后临床情况相对稳定,但随访影像显示手术部位病灶进展,同时在左侧颞叶凸面出现新的硬膜基底结节性强化灶,考虑可能为脑膜播散。
此时,患者接受3个月常规放疗,并对左侧CPA区域实施伽马刀强化照射。遗憾的是,肿瘤在放疗期间继续进展,MRI显示肿瘤向侧方侵入Meckel腔,并向左小脑幕后方延伸。
全外显子测序显示SMARCA4突变,随后开始Vorinostat+顺-维甲酸(cis-retinoic acid)化疗。尽管采取了积极治疗,肿瘤仍快速进展,累及左侧海绵窦、眶区及颅中窝。患者在短期姑息治疗后去世,距首次诊断约1年。
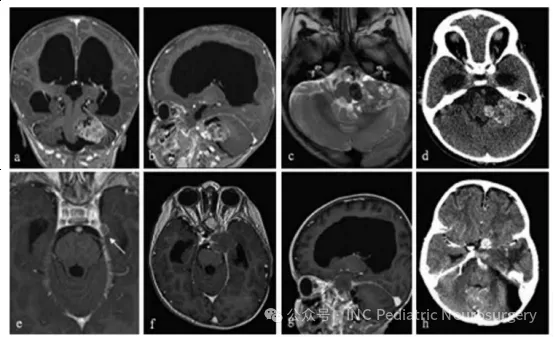
图6. 患者10左桥小脑角区脊索瘤影像学随访资料
(a)术前轴位T1加权钆增强MRI;
(b)术前矢状位T1加权钆增强MRI;
(c)术前轴位T2加权MRI;
(d)术前轴位CT扫描;
(e)术后5个月轴位T1加权钆增强MRI,显示左颞部新发硬膜病变(箭头);
(f)术后9个月轴位T1加权钆增强MRI;
(g)术后9个月矢状位T1加权钆增强MRI;
(h)术后12个月轴位CT扫描。
04PART 研究结论
脊索瘤是一类起源于脊索残余的异质性肿瘤,其解剖位置和组织病理学特征各不相同。本系列报道了1987-2015年期间在SickKids儿童医院治疗的10例颅底及上颈段脊索瘤患者,年龄范围从14个月至13岁。按照当前治疗规范,所有患者均接受最大安全范围的手术切除,随后进行放疗及个体化化疗。
组织病理学类型是最关键的预后因素;4例非典型或软骨样病理患者在随访4-38个月期间均死亡。长期神经功能缺损则取决于疾病范围、手术方式及局部放疗的综合影响。
本系列10例患者的数据总结了SickKids儿童医院30年的诊疗经验,旨在为其他神经外科医生在应对儿童脊索瘤这一挑战性肿瘤时提供参考。
05PART 关于作者


- 所属栏目:脊索瘤
- 如想转载“儿童脊索瘤的管理与预后:SickKids儿童医院经验及文献综述”请务必注明来源和链接。
- 网址:https://www.incsg.com/jisuoliu/7113.html
- 更新时间:2025-11-25 10:20:49
- 上一篇:脊索瘤共病有哪些?会引起哪些并发症?
- 下一篇:功能区脊索瘤手术风险有哪些?







