2021年国际卫生组织中枢神经系统肿瘤分类(五版)分子诊断指标解读
发布时间:2021-11-04 11:51:20 | 阅读:次| 关键词:
- [案例]6岁男孩车祸“撞出”脑肿瘤,为何“因祸得福”?
- [案例]国际颅底教授“零并发症”全切较大颅咽管瘤,35岁精英重
- [案例]视路胶质瘤治疗陷困局:近失明患者该如何突破“切不净
- [案例]脑海绵状血管瘤“吃透”的中脑,脑干出血急送ICU的她如
- [案例]“虽小,却危及性命” 脑干海绵状血管瘤出血成功手术重
- [案例]北美可能再也没有比SickKids更好的儿童医院了
【摘要】2021年国际卫生组织中枢神经系统肿瘤分类(五版,简称新版肿瘤分类)在组织学诊断的基础上引入一系列分子诊断指标,形成整合诊断及分层报告体系,并新定义多种瘤种和亚型,反映出目前神经肿瘤相关领域对此类疾病遗传背景和临床特征的理解。本文综述新版肿瘤分类关键的分子诊断指标及相应检测方法,旨在为临床认识疾病、管理肿瘤患者提供帮助。

随着病理学的发展和病理检测技术的进步,是二代测序技术(NGS)、全基因组甲基化测序(WGBS)等组学技术的提高,肿瘤遗传背景和发生发展机制逐渐清晰。越来越多的分子生物学标志物被证实在中枢神经系统(CNS)肿瘤分类、分型、分级、治疗和预后方面发挥重要作用。2016年国际卫生组织(WHO)中枢神经系统肿瘤分类四版修订版(以下简称四版修订版)一次在组织学形态的基础上引入分子表型,提出整合诊断的理念,旨在提高病理诊断的客观性和可重复性,完善个体化管理流程,促进临床试验、基础实验和流行病学研究的开展,并为优化资源配置、制定政策提供支持[1⁃2]。
然而,四版修订版是组织病理学和分子病理学整合后的一次尝试,许多暂定的肿瘤实体仍待进一步研究[2⁃3]。经过5年的实践和完善,2021年WHO中枢神经系统肿瘤分类(五版,以下简称新版肿瘤分类)在整合较新研究进展与中枢神经系统肿瘤分子信息与分类实践联盟⁃非WHO官方组织(cIMPACT⁃NOW)7次更新的基础上,制定新的肿瘤分类体系和分级标准,重点推进分子诊断在中枢神经系统肿瘤分类中的应用[4]。本文拟对中枢神经系统肿瘤分子诊断指标进行解读,其中基因变异以斜体字表示,蛋白质和基因家族则以正体字表示(表1)[4]。尽管新版肿瘤分类并不分子检测的具体方法,但本文对常用的分子检测技术进行简要介绍,为更好地理解分子检测提供帮助。
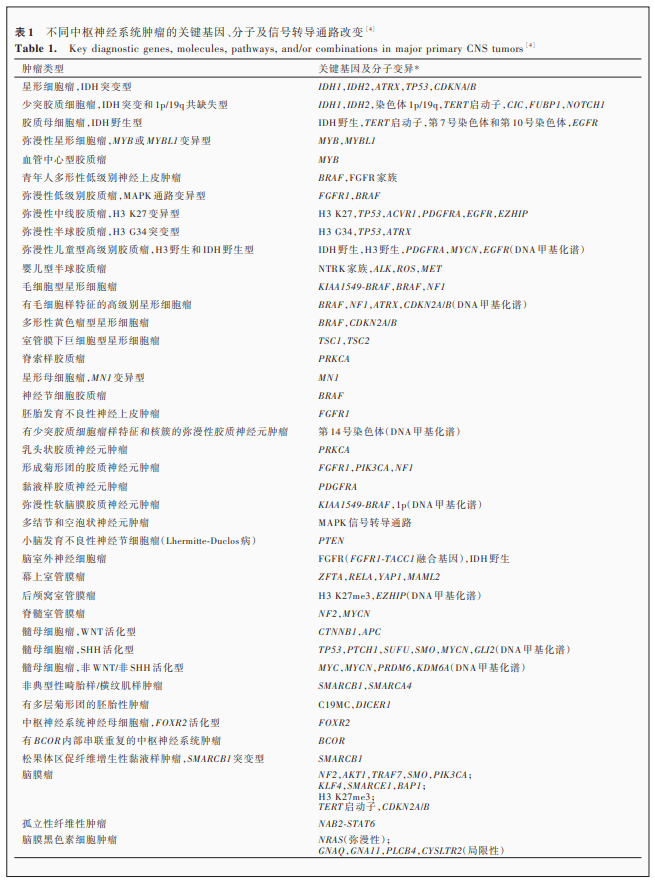

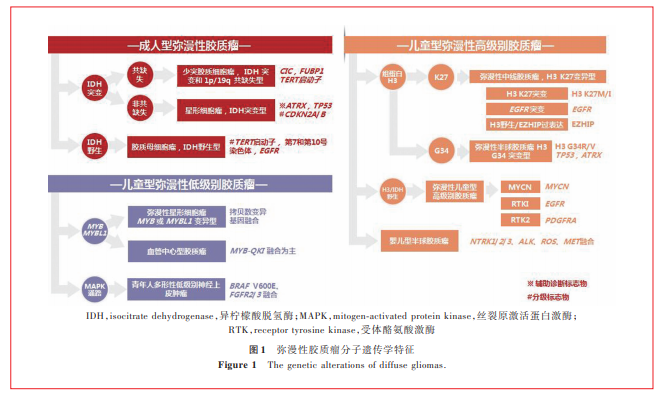
一、中枢神经系统常见肿瘤分子变异
1.成人型弥漫性胶质瘤
IDH突变是成人型弥漫性胶质瘤的重要诊断标志物。脑胶质瘤较常见的IDH突变为IDH1基因132位密码子突变(以R132H突变较常见,其他包括R132C、R132S、R132G和R132L等),其余为IDH2基因172位密码子突变(包括R172G、R172M和R172W等)及其他少见密码子突变(如IDH1 R49等)[5⁃7]。IDH突变的弥漫性胶质瘤若伴1p/19q共缺失,则诊断为少突胶质细胞瘤,IDH突变和1p/19q共缺失型;其中,TERT启动子突变、NOTCH1突变、FUBP1突变和CIC突变是此种类型胶质瘤的常见分子特征[8];IDH突变但是不伴1p/19q共缺失的弥漫性胶质瘤,诊断为星形细胞瘤,IDH突变型;ATRX突变、TP53突变是此种类型胶质瘤的典型分子变异,也是重要的辅助诊断标志物[7⁃9];而CDKN2A/B纯合性缺失是此种类型肿瘤的分级标志物,有CDKN2A/B缺失的IDH突变型星形细胞瘤诊断为星形细胞瘤,IDH突变型,CNS WHO 4级[4,9](图1)。组织学形态表现为坏死或微血管增生的IDH野生型弥漫性胶质瘤,则诊断为胶质母细胞瘤,IDH野生型[1,4];组织学形态呈CNS WHO 2级或3级的IDH野生型弥漫性星形细胞瘤,如果有EGFR扩增、7号染色体扩增/10号染色体缺失(+7/-10)、TERT启动子突变上述3种分子变异之一,也可诊断为胶质母细胞瘤,IDH野生型[10],同时这3种分子变异也是此类肿瘤预后相关的分子生物学标志物[10]。
2.儿童型弥漫性低级别胶质瘤
新版肿瘤分类一次引入儿童型弥漫性低级别胶质瘤的概念,组织学形态表现为弥漫性低级别胶质瘤,主要发生于儿童,亦可见于成人,通常有癫病史[11]。分子变异分为MYB或MYBL1变异型和丝裂原激活蛋白激酶(MAPK)通路变异型两大类[4]。
(1)MYB或MYBL1变异型:MYB是含MYB/SANT结构域转录因子家族的基因之一,在控制造血及其他祖细胞增殖和分化中发挥重要作用,在白血病和实体肿瘤中扮演原癌基因的角色[12]。MYBL1基因的作用与之类似[12]。MYB或MYBL1变异形式包括基因拷贝数变异和基因融合(MYB伴侣基因有QKI、ESR1、MMP16、MAML2、PCDHGA1等,MYBL1伴侣基因有RAD51B、MAML2、ZFHX4、TOX等)[12⁃15]。尽管研究显示,MYB或MYBL1变异的低级别胶质瘤具有相似的DNA甲基化谱(DNA methylome patterns),但尚待多中心大样本研究进一步证实[14]。新版肿瘤分类结合组织学形态和分子特征将MYB或MYBL1变异型肿瘤分为弥漫性星形细胞瘤,MYB或MYBL1变异型和血管中心型胶质瘤(MYB⁃QKI融合常见)两种类型[4]。
(2)MAPK通路变异型:MAPK信号转导通路是真核细胞重要的信号转导系统,通过三级激酶级联反应转导细胞外信号,参与细胞生长、分化、凋亡等多种生理过程,与肿瘤发生发展密切相关[12]。胶质瘤MAPK通路相关基因变异包括NF1、BRAF、FGFR1、CRAF、NTRK、PTPN11、ROS1等[12]。青年人多形性低级别神经上皮肿瘤(PLNTY)的分子变异包括BRAF V600E、FGFR3⁃TACC3融合、FGFR2⁃CTNNA3融合、FGFR2⁃KIAA1598融合[16⁃17]。弥漫性低级别胶质瘤,MAPK通路变异型的常见分子变异包括FGFR1酪氨酸激酶结构域(TKD)重复、FGFR1突变、FGFR1融合,以及BRAF V600E突变、BRAF融合、BRAF插入突变[18]。由于MAPK通路变异型肿瘤中部分分子变异缺乏特异性,故组织学形态和免疫组化染色等经典病理诊断方法和结果重要。
3.儿童型弥漫性高级别胶质瘤
(1)组蛋白H3变异型:H3是参与真核细胞染色质结构的5个主要组蛋白之一,其序列变异和修饰状态在基因的动态和长期调控中发挥重要作用。新版肿瘤分类新增弥漫性中线胶质瘤,H3 K27变异型,进一步拓展弥漫性中线胶质瘤的定义[4]。根据分子变异分为3种亚型,即H3 K27突变型[19⁃20](包括H3 K27M和H3 K27I)、EGFR突变型[21⁃22](多累及丘脑)、H3野生伴EZHIP过表达型[23]。H3 K27突变发生于H3.3(编码基因H3F3A)和H3.1(编码基因HIST1H3B/C),其中H3F3A突变率约为HIST1H3B/C的3倍,且预后更差[20]。TP53突变、ACVR1突变、PPM1D突变和PDGFRA扩增等分子变异是H3 K27突变型弥漫性中线胶质瘤的常见分子遗传学特征[1]。另一携带组蛋白H3变异的肿瘤是弥漫性半球胶质瘤,H3 G34突变型,主要发生于大脑半球,表现为组蛋白H3.334位甘氨酸(Gly)被精氨酸(Arg)或缬氨酸(Val)取代的错义突变(H3.3 G34R/V)[24⁃25]。胶质瘤H3.3 G34突变主要发生于H3F3A基因,常伴ATRX突变、TP53突变[24]。
(2)H3野生和IDH野生型:弥漫性儿童型高级别胶质瘤,H3野生和IDH野生型好发于儿童和青年,具备高级别肿瘤组织学特征,但分子病理学特征表现为IDH野生型、组蛋白H3野生型。根据DNA甲基化特征可以分为儿童型高级别胶质瘤RTK1型、儿童型高级别胶质瘤RTK2型和儿童型高级别胶质瘤MYCN型,其中,RTK2型伴高频率的EGFR扩增和CDKN2A/B纯合性缺失,预后较好;MYCN型伴高频率的MYCN扩增和ID2扩增,预后较差;RTK1型伴高频率PDGFRA扩增[26]。(3)婴儿型半球胶质瘤:主要发生于婴幼儿,位于大脑半球,分子遗传学特征为受体酪氨酸激酶(RTK)家族变异,主要包括NTRK家族基因(NTRK1/2/3)融合、ROS1融合、MET融合、ALK融合[28⁃29]。
4.局限性星形细胞胶质瘤
毛细胞型星形细胞瘤较常见的分子变异是KIAA1549⁃BRAF融合(>70%),其他变异包括其他形式的BRAF融合(伴侣基因为FAM131B、RNF130等)、BRAF V600E突变、NF1突变、FGFR1变异(包括突变、融合或内部串联重复)等[1]。多形性黄色瘤型星形细胞瘤较常见的是BRAF V600E突变,其他变异包括CDKN2A/B纯合性缺失、3和7号染色体获得等[1];由于多形性黄色瘤型星形细胞瘤亦可部分携带TERT启动子突变[11],因此诊断IDH野生型且仅TERT启动子突变肿瘤时,须注意组织学诊断的准确性。室管膜下巨细胞型星形细胞瘤发病与多发性硬化密切相关,故常伴TSC1和TSC2突变[1]。脊索样胶质瘤较常见的分子变异为PRKCA D463H突变[29⁃30],部分肿瘤还可携带BRAF V600E突变[31]。有毛细胞样特征的高级别星形细胞瘤是新版肿瘤分类新定义的肿瘤,具有特征性DNA甲基化谱,但是组织学特征无特异性。部分肿瘤表现出间变性和毛细胞样组织学特征,同时伴高频率MAPK通路基因变异(包括BRAF突变和融合、NF1突变、FGFR1突变和融合、KRAS突变),CDKN2A/B纯合性缺失和ATRX突变[32⁃34]。具有典型星形母细胞瘤组织学形态的肿瘤,若携带MN1变异(MN1⁃BEND2融合和MN1⁃CXXC5融合,常伴染色体22q和X染色体大量杂合性缺失),则可诊断为星形母细胞瘤,MN1变异型[35⁃37]。
5.胶质神经元和神经元肿瘤
MAPK通路相关基因变异是多种胶质神经元和神经元肿瘤的典型分子病理学特征。神经节细胞胶质瘤较常见的分子变异是BRAF V600E突变(20%~60%)[1],还涉及多种BRAF融合(伴侣基因包括MACF1、AGK、GNAI1、KIAA1549、FXR1)[1,18]。胚胎发育不良性神经上皮肿瘤FGFR1酪氨酸激酶结构域重复、FGFR1突变和FGFR1⁃TACC1融合常见[18],同时可检测到BRAF V600E突变或融合、PDGFRA突变等[18,38⁃39]。形成菊形团的胶质神经元肿瘤以FGFR1突变较常见(突变形式包括N546K和K656E),伴PIK3CA突变、NF1突变,偶见PTPN11突变[40]。弥漫性软脑膜胶质神经元肿瘤常见KIAA1549⁃BRAF融合和1号染色体短臂缺失[41],基于其DNA甲基化特征可以分为两种亚型,MC⁃1型(1p/19q共缺失比例较高)和MC⁃2型(伴染色体1q获得)[42]。其中,MC⁃2型无进展生存期(PFS)和总生存期(OS)较差,可能与染色体1q获得有关[43]。多结节和空泡状神经元肿瘤的典型分子变异也与MAPK通路相关,包括BRAF突变、MAP2K1变异(突变和阅读框内缺失)以及FGFR2⁃INA融合[44]。脑室外神经细胞瘤主要特征为FGFR1⁃TACC1融合(60%),亦可见FGFR3⁃TACC3融合和FGFR1⁃EVI5融合[45]。其他常见分子变异包括乳头状胶质神经元肿瘤常见的PRKCA融合(主要为SLC44A1⁃PRKCA融合,偶见NOTCH1⁃PRKCA融合)[46⁃47]以及小脑发育不良性神经节细胞瘤(Lhermitte⁃Duclos病)的PTEN胚系变异[1]。新版肿瘤分类新增的两种类型肿瘤中,黏液样胶质神经元肿瘤伴PDGFRA K385突变(K385L/I)[48⁃49],其DNA甲基化特征与胚胎发育不良性神经上皮肿瘤相似;有少突胶质细胞瘤样特征和核簇的弥漫性胶质神经元肿瘤也是具有特征性DNA甲基化谱的肿瘤,伴14号染色体单体,常发生于儿童[50]。
6.室管膜肿瘤
室管膜肿瘤的分子特征与其解剖部位、年龄等因素密切相关[51]。幕上室管膜瘤以融合基因为主要特征,可分为ZFTA融合阳性型和YAP1融合阳性型。ZFTA(C11orf95)的融合方式主要为ZFTA⁃RELA融合,导致核因子⁃κB(NF⁃κB)信号转导通路过度激活,预后相对较差[52⁃53];其他融合方式包括ZFTA⁃MAML2,ZFTA⁃NCOA1等,ZFTA融合阳性的幕上室管膜瘤有相似的DNA甲基化特征[52]。YAP1融合的方式主要为YAP1⁃MAMLD1融合,部分为YAP1⁃FAM118B融合,YAP1融合阳性型主要发生于儿童(<3岁),预后相对较好[54⁃55]。非ZFTA非YAP1融合的幕上室管膜瘤比例较低,部分伴MAML2⁃ASCL2、MARK2⁃ADCY3、RTN3⁃NCOA1、MTMR3⁃NCOA3等融合,部分缺乏典型分子病理学特征(组织学形态表现为伸长细胞型室管膜瘤或星形母细胞瘤)[54,56]。后颅窝室管膜瘤表现为特征性DNA甲基化谱,可分为PFA组和PFB组[57]。PFA组主要发生于婴幼儿,多数具有间变性特征,预后较差,组蛋白H3 K27me3表达缺失、CXorf67过表达;PFB组主要发生于大龄儿童或者成人,预后相对较好,组蛋白H3 K27me3表达正常[58⁃59]。染色体1q获得也是后颅窝室管膜瘤预后不良的生物学标记之一[51]。脊髓室管膜瘤中有一类以MYCN扩增为特征,具有很强的侵袭性和转移能力,预后较差[60]。由于脊髓室管膜瘤是2型神经纤维瘤病的特征性病变之一,故常伴NF2变异[1]。
7.胚胎性肿瘤
四版修订版已对髓母细胞瘤进行分子分型,新版肿瘤分类延续这一分子分型体系,并予以更详细阐释[1,4]。WNT活化型较常见的分子变异为CTNNB1突变和6号染色体单体,其次为DDX3X、SMARCA4、KMT2D、TP53、PIK3CA、CSNK2B等突变,APC胚系变异与该亚型的发生具有相关性[1,61]。SHH活化型的常见分子变异为TP53、PTCH1、SUFU、SMO等突变,MYCN、GLI1、GLI2等扩增,9号染色体长臂、10号染色体长臂、17号染色体短臂缺失,以及TERT启动子突变等[61]。非WNT/非SHH活化型的常见分子变异为MYC、MYCN、OTX2等扩增,GFI1、GFI1B、PRDM6激活,SMARCA4、KBTBD4、CTDNEP1、KMT2D、KDM6A、ZMYM3、KMT2C、KMT2D等突变。基于DNA甲基化特征,SHH活化型分为α、β、γ、δ共4种亚型,非WNT/非SHH活化型分为8种亚型,不同亚型临床特征及驱动基因有所不同[62]。其他中枢神经系统胚胎性肿瘤中,非典型性畸胎样/横纹肌样肿瘤(AT/RT)典型分子变异为SMARCB1或SMARCA4突变,基于DNA甲基化特征将SMARCB1突变的肿瘤分为3种亚型,即AT/RT⁃TYR型、AT/RT⁃SHH型和AT/RT⁃MYC型[63]。有多层菊形团的胚胎性肿瘤的典型分子变异为C19MC扩增[染色体19q13.42,涵盖一簇微小RNA(miRNA),约90%]、DICER1突变(约5%)、MIR17HG扩增(miRNA17~92簇)[1,64⁃65]。中枢神经系统神经母细胞瘤,FOXR2活化型的组织学形态表现为神经母细胞瘤或节细胞神经母细胞瘤(GNB),分子病理学特征为染色体重排致FOXR2过表达(包括重复、缺失、易位、线粒体基因插入等,部分产生FOXR2相关融合基因),常伴染色体1q获得,具有独特的DNA甲基化特征[66]。有BCOR内部串联重复的中枢神经系统肿瘤典型的分子病理学特征为BCOR基因外显子15内部串联重复[66⁃67]。
8.脑膜瘤
脑膜瘤是较常见的原发性颅内肿瘤,其分子变异与性别、肿瘤解剖部位等具有相关性[68]。约60%的脑膜瘤可检出NF2变异,包括移码突变、等位基因失活、错义突变等[1,69]。非NF2变异的脑膜瘤较复杂,包括Hedgehog信号转导通路变异(SMO、SUFU、PRKAR1A、PTCH1/2等)、磷脂酰肌醇3⁃激酶(PI3K)信号转导通路变异(PTEN、AKT1、PIK3CA、PIK3R1等)、染色体重塑复合物变异(SMARCB1、SMARCE1、ARID1A、PBRM1等)及其他基因变异(KLF4、BAP1、POLR2A、DMD等)[70]。部分分子病理学特征与脑膜瘤组织学亚型相关,例如TRAF7和KLF4突变是分泌型脑膜瘤的分子生物学标志物[70],TRAF7、POLR2A、ATK1突变是内皮型脑膜瘤的标志物[69⁃70],SMARCE1突变是透明细胞型脑膜瘤的标志物[71],BAP1和PBRM1突变是横纹肌样型脑膜瘤和乳头状型脑膜瘤的标志物[72⁃73]。另一部分与肿瘤恶性程度有关,如组蛋白H3 K27me3表达缺失与脑膜瘤复发密切相关[74⁃75],TERT启动子突变和CDKN2A/B纯合性缺失是CNS WHO 3级脑膜瘤的分子生物学标志物[76⁃77]。此外,染色体1p、6q、9p、10、14q、18q、22q缺失,染色体1q、9q、12q、15q、20q获得以及某些基因(如NRDG2、MEG3、PDGFR等)DNA甲基化水平或表达变化也与脑膜瘤的发生发展密切相关[1,70]。基于DNA甲基化特征,脑膜瘤分为两组6型,其中,A组包括benign⁃1型、benign⁃2型、benign⁃3型和intermediate A型,B组包括intermediate B型、malignant型,不同亚型的解剖部位、驱动基因和临床预后等有所差异[78]。值得注意的是,发生于儿童的脑膜瘤有不同的分子病理学特征,除与肿瘤易感综合征相关的分子变异外,YAP1融合可能与部分NF2野生型儿童脑膜瘤有关[79]。
9.中枢神经系统其他肿瘤
松果体区促纤维增生性黏液样肿瘤,SMARCB1突变型发生于松果体区。免疫组化染色,胞核整合酶相互作用分子1(INI⁃1)表达缺失、而表达上皮膜抗原(EMA)和CD34,分子病理学特征为SMARCB1缺失(纯合性或杂合性缺失)或移码突变,与AT/RT⁃MYC型具有相似的DNA甲基化特征[80]。孤立性纤维性肿瘤的典型分子变异为NAB2⁃STAT6融合。免疫组化染色,胞核表达信号传导与转录激活因子6(STAT6)[1]。弥漫性脑膜黑色素细胞肿瘤包括脑膜黑色素细胞增生症和脑膜黑色素瘤病,NRAS(常见突变位点为Q61)突变频率较高[81];局限性脑膜黑色素细胞肿瘤包括脑膜黑色素细胞瘤和脑膜黑色素瘤,则可检测到GNAQ(常见突变位点为Q209)、GNA11(常见突变位点Q209)、CYSLTR2(常见突变位点L129)、PLCB4(常见突变位点D630)、BAP1、EIF1AX、SF3B1等突变[82⁃83]。牙釉质细胞瘤型颅咽管瘤以CTNNB1突变为特征(约95%),乳头状型颅咽管瘤以BRAF V600E突变为特征(81%~95%),二者具有特征性DNA甲基化谱,新版肿瘤分类将上述肿瘤归为不同类型[4,84]。
二、常用分子病理学检测技术
中枢神经系统分子病理学检测应选择同类方法中结果稳定、重复性佳、特异性高的技术,同时亦应考虑样本量、肿瘤异质性、检测项目多少等,综合选择适宜的检测方法。检测过程中须严格参照国家卫生健康委员会制订的《肿瘤个体化治疗检测技术指南(试行)》进行标准化操作和质量控制。
1.免疫组化染色
免疫组化染色是一种经济、便捷、稳定的检测技术,利用抗体与组织内抗原的特异性结合,对抗原进行定性、定位和相对定量检测,是临床实践较常用的分子病理学检测方法[7]。除鉴别肿瘤起源、明确分化方向、判断增殖活性外,其在分子诊断方面的应用还包括:(1)直接反映分子变异类型和位点,如应用IDH1 R132H(H09)、BRAF V600E(VE1)、H3 K27M、H3 G34R、H3 G34V等突变特异性抗体。(2)通过编码蛋白表达水平或模式反映该基因变异,如胞核ATRX表达缺失、胞核β⁃catenin阳性、胞核STAT6阳性、胞核INI⁃1表达缺失等。(3)通过相关蛋白的表达推断基因变异,如L1细胞黏附分子(L1CAM)阳性与ZFTA⁃RELA融合、LIN28A弥漫性阳性与C19MC扩增、H3 K27me3表达缺失与后颅窝室管膜瘤,PFA组等。由于NGS等其他高通量分子检测技术耗时长、费用高、对样本和检测设备要求较高,通过寻找不同免疫组化指标替代其他分子检测方法仍是目前病理学研究的方向之一。例如,对于星形细胞瘤,IDH突变型,免疫组化染色,胞核ATRX表达缺失和(或)P53弥漫性强阳性(>10%),可在不进行1p/19q检测的情况下明确诊断[7,9]。
2.荧光原位杂交
荧光原位杂交(FISH)系通过荧光标记的DNA探针与胞核内DNA靶序列杂交,并在荧光显微镜下观察分析其结果的分子细胞遗传学技术,可对基因缺失、基因扩增、基因重排(断裂⁃分离探针)、基因融合(融合探针)等进行检测。FISH技术空间定位精确,敏感性和特异性较好,可检测隐匿或微小的染色体畸变和复杂核型,目前广泛应用于临床。中枢神经系统肿瘤的一些重要分子改变,如1p/19q共缺失、EGFR扩增、MN1重排、KIAA1549⁃BRAF融合等均可行FISH检测,但该项技术对操作和结果判读要求较高,且成本昂贵,通量低,故需多个分子诊断指标联合分析时,局限性较大。同时,整合FISH检测结果时还应注意潜在的假阳性或假阴性结果,如染色体1p/19q FISH探针仅覆盖1p36和19q13区域,无法区分部分缺失和整臂缺失[85];小于探针长度的CDKN2A微小缺失无法经FISH检出,可能出现假阴性结果[86]。
3.Sanger测序、焦磷酸测序及其他基于聚合酶链反应的检测技术
(1)Sanger测序:系经典的DNA序列分析方法,可检测已知和未知的变异位点,包括少见的突变形式和确切的突变类型,如点突变、片段缺失,被认为是基因分型的“金标准”。但敏感性较低,等位基因突变率>20%方可检出且通常要求肿瘤细胞比例≥50%。
(2)焦磷酸测序(pyrosequencing):系一种可定量检测样品中单核苷酸突变水平的方法,适用于对已知短序列进行重测序分析,在表观遗传学研究中逐渐成为数据分析的“金标准”[87],检测灵敏度为10%,重复性和精确性可与Sanger测序媲美,且通量较高,但缺点是无法对长片段进行分析。(3)其他基于聚合酶链反应(PCR)的检测技术:扩增阻滞突变系统(ARMS)⁃PCR、高分辨率熔解曲线(HRM)、数字PCR(digital PCR)、荧光实时定量PCR等,目前已用于中枢神经系统肿瘤TERT启动子突变、IDH突变、1p/19q共缺失、MGMT启动子甲基化等的检测[88⁃89]。NanoString数字化基因分析系统(NanoString nCounter Technology)系通过对探针上颜色分子条形码标记直接探测、计数以实现多重定量检测的技术,敏感性和准确性与荧光实时定量PCR相当,通量高,操作流程便捷[90]。该项技术通过对髓母细胞瘤重要基因表达进行检测,从而快速、稳定进行肿瘤分子分型,是目前髓母细胞瘤分子诊断的重要方法。
4.二代测序技术
NGS亦称大规模平行测序,可高通量地检测分析肿瘤驱动基因变异或治疗靶点,给患者带来治疗和生存获益。该项技术用于中枢神经系统肿瘤的分子诊断可以一次性获得覆盖基因组特定区域(启动子、外显子、内含子等)的高通量数据,同时可以检测多种基因变异形式(突变、插入或缺失、重排、拷贝数变异等)[91]。然而,传统NGS仅覆盖部分常见融合基因,无法检测全部可能出现的基因融合。因此,mRNA二代测序(next⁃generation mRNA sequencing)有助于发现肿瘤诊断、分类和靶向治疗重要的、少见的、新的融合基因[92]。检测过程中采用的NGS技术平台应符合技术诊断标准,达到合适测序深度要求,遵循标准化检测流程,纳入必需的分子指标、试剂和方法以进行严格的管理和质控、对每个基因变异位点进行明确的注释和合理的遗传咨询[91]。
5.DNA甲基化谱
基于DNA甲基化特征的分析已经成为中枢神经系统肿瘤分类的重要方法之一,不仅可获得肿瘤的甲基化信息,还可获得拷贝数变异(扩增、缺失、基因融合等)。当与其他标准技术(如组织学)共同应用时,DNA甲基化分析是脑和脊髓肿瘤分类的合适辅助方法,对于特征不、少见的瘤种和亚型[4,93]。与其他诊断技术一样,判读检测结果时须考虑组织学特征(如肿瘤细胞数目和纯度)。新版肿瘤分类假定几乎全部(但是并非全部)瘤种均具有特征性DNA甲基化谱。
三、结论
新版肿瘤分类反映了目前知识背景下相关领域专家对中枢神经系统肿瘤的理解,应视为中枢神经系统肿瘤分类的一个阶段。相信新版肿瘤分类正式发布后,随着新型检测技术的大规模应用,会发现越来越多与肿瘤相关的新的分子变异;同时,随着相关临床试验的开展,我们对中枢神经系统肿瘤分类体系的理解也将更加深刻。希望这些变化及其解释可以为神经病理学家和神经肿瘤学家的临床实践提供指导,从而使患者获益。
文章来源:刘幸陈慧媛邹婉婧李桂林.2021年国际卫生组织中枢神经系统肿瘤分类(五版)分子诊断指标解读.中国现代神经疾病杂志2021年9月21卷9期
参考资料较多,可查阅原文

- 所属栏目:脑瘤
- 如想转载“2021年国际卫生组织中枢神经系统肿瘤分类(五版)分子诊断指标解读”请务必注明来源和链接。
- 网址:https://www.incsg.com/naoliu/1235.html
- 更新时间:2021-11-04 11:47:15







