巴罗神经学研究所关于原发性恶性胶质瘤的治疗论述
在美国,每年诊断出约15,000例新的成人中枢神经系统(CNS)肿瘤病例,并且每年有11,000例死亡归因于这些肿瘤。小儿脑瘤的数量较少,但每年诊断出约1200例新病例,它们现在是儿童因癌症死亡的主要原因。在成人中,低级神经胶质瘤倾向于发生在20至40岁的患者中,中级神经胶质瘤倾向于在40至55岁的患者中,高度恶性神经胶质瘤倾向于在55岁以上的患者中发生。一些证据表明,年龄在70岁以上的患者的恶性神经胶质瘤的发病率正在增加, 但这个问题存在争议。在儿童中,脑肿瘤常见于3至12岁之间。脑肿瘤对性别的影响不同。胶质瘤是成人中常见的中枢神经系统肿瘤,男性多于女性。对于脑膜瘤,反之亦然。多形胶质母细胞瘤(GBM)发生较频繁,其次是脑膜瘤和星形细胞瘤。儿童期常见的恶性肿瘤是小脑髓母细胞瘤。以下讨论仅限于成人的神经胶质瘤。
胶质瘤分类系统将分化良好的星形细胞瘤分为恶性肿瘤的低级别,将GBM分为高级别,将间变性星形细胞瘤(AA)置于中间。星形细胞瘤和AA的区别是基于后者的有丝分裂率较高。坏死的额外存在将肿瘤定义为GBM。一种较新的基于组织学的分类系统似乎与预后良好相关(Daumas-Duport)。该系统基于核异常,有丝分裂,内皮增殖和坏死的相对影响。国际卫生组织(WHO)已对该系统进行了修改,以定义与肿瘤侵袭性相关的肿瘤。 I级神经胶质瘤通常是年轻人中的毛细胞星形细胞瘤。二级神经胶质瘤包括星形细胞瘤和少突胶质细胞瘤。III级神经胶质瘤由AA和间变性少突神经胶质瘤组成;IV级神经胶质瘤是胶质母细胞瘤。
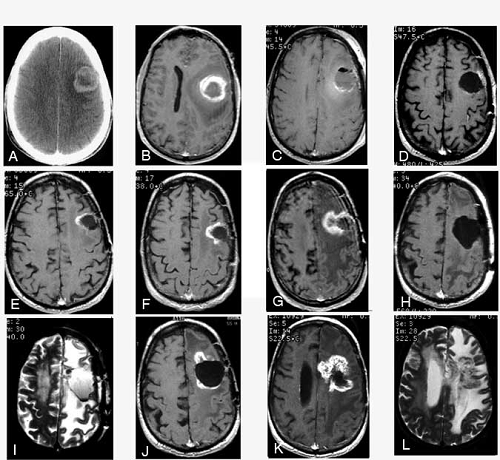
图1:1994年10月,一名52岁男子出现全身性强直-阵挛性惊厥。(A)计算机断层扫描(CT)显示左额叶增强造影剂。(B)含g的T1加权磁共振(MR)图像显示左额叶肿瘤增强,该肿瘤于1994年10月20日切除,被诊断为多形胶质母细胞瘤。该患者失语症,右偏瘫。(C)术后1天获得的不含without的T1加权MR图像显示肿瘤床有出血,但他的神经系统状况迅速好转。然后,他对肿瘤进行了束外放射疗法,其边缘长3厘米,总计60 Gy,并且还开始了卡莫斯汀(BCNU)化疗。(D)1994年12月19日,使用g的T1加权MR图像显示出干净的肿瘤床。在1995年1月的一个星期中,他接受了125 I放射性种子植入,并在肿瘤床上再接受了60 Gy的剂量。他完全康复并重新工作。但是六个月后,逐渐的疲劳和二次发作导致他停止工作。到1995年底,他已经完成了BCNU的整个疗程,并且MR成像未显示出肿瘤的生长。尽管他的抗癫痫药发生了一些变化,但他仍然偶尔会发作。
到1996年12月,他的病情开始恶化,并出现轻度失语症。用1-进行的T1加权MR成像显示内侧早期增强(未显示)。(E)T2加权图像显示在肿瘤床边缘靠近病变处的水肿。到1997年3月,在用F进行的(T)T1加权MR成像上,增强区域已经扩大。MR光谱表明该区域是放射坏死。(G)T1加权MR成像显示增强区域显着增加。病人的失语症恶化了,他出现了严重的右偏瘫。MR光谱再次表明增强的质量是放射坏死。在1997年7月15日切除该肿块。术后,(H)含T的T1加权MR图像和(I)含T2加权MR图像显示切除床。病理分析证实了放射性坏死的诊断。尽管他在命名方面仍然有困难,但患者的无力状态随着言语得到了好转。到1997年12月,他发展出了更深刻的表现性失语症,发作性混乱和中度右偏瘫。(J)含g的T1加权MR图像显示邻近先前病变进一步增强。到1998年2月,患者被限制在家中服用抗惊厥药物和适量地塞米松。(K)含T的T1加权MR图像和(L)T2加权的MR图像显示,随着水肿面积(L)的增加,病灶进一步增加,与放射坏死的增加一致。尽管他在命名方面仍然有困难。到1997年12月,他发展出了更深刻的表现性失语症,发作性混乱和中度右偏瘫。(J)含g的T1加权MR图像显示邻近先前病变进一步增强。到1998年2月,患者被限制在家中服用抗惊厥药物和适量地塞米松。(K)含T的T1加权MR图像和(L)T2加权的MR图像显示,随着水肿面积(L)的增加,病灶进一步增加,与放射坏死的增加一致。尽管他在命名方面仍然有困难。到1997年12月,他发展出了更深刻的表现性失语症,发作性混乱和中度右偏瘫。(J)含g的T1加权MR图像显示邻近先前病变进一步增强。到1998年2月,患者被限制在家中服用抗惊厥药物和适量地塞米松。(K)含T的T1加权MR图像和(L)T2加权的MR图像显示,随着水肿面积(L)的增加,病灶进一步增加,与放射坏死的增加一致。患者被限制在家中,服用抗惊厥药物和适量地塞米松。(K)含T的T1加权MR图像和(L)T2加权的MR图像显示,随着水肿面积(L)的增加,病灶进一步增加,与放射坏死的增加一致。患者被限制在家中,服用抗惊厥药物和适量地塞米松。(K)含T的T1加权MR图像和(L)T2加权的MR图像显示,随着水肿面积(L)的增加,病灶进一步增加,与放射坏死的增加一致。
恶性胶质瘤
在过去的30年中,用于恶性神经胶质瘤的多模态疗法(细胞减少手术,放射疗法,化学疗法)已以一种或另一种形式使用。这些经验大部分是由单个机构和合作小组试验进行的临床研究的直接产物。简要回顾每种方式,重点关注较近的结果和争议。
手术治疗
基于原发性恶性脑胶质瘤的治疗经验,手术仍是恶性胶质瘤的主要治疗手段。手术允许不仅切除肿瘤,也能够进行病理诊断。但是,许多医生认为,当前的放射学诊断方法,是磁共振(MR)成像,可以在不使患者遭受手术切除的风险的情况下诊断出恶性脑肿瘤。立体定向活检可提供足够的组织来证实原发性神经胶质瘤的诊断。但是,从穿刺活检获得的组织数量可能不足以分级肿瘤。此外,仅进行立体定向活检,甚至进行小型开放式颅骨切开活检,都无法将手术作为“癌症”疗法发挥作用。随着激光的出现,手术已大大好转。较近,诸如ISG技术(ISG Technologies)之类的计算机辅助导航设备使恶性神经胶质瘤患者的精确切除成为可能。
手术将肿瘤减少到很小的残留量与延长生存期相关。在一项脑肿瘤合作小组(BTCG)研究中,对脑肿瘤患者的计算机断层扫描(CT)扫描在其治疗过程中进行了多次研究,并与结果进行了比较。术前肿瘤大小与预后无明显关系。相反,术后肿瘤大小与生存期之间存在强的反比关系。这种趋势在残留增强肿瘤较少或没有残留的患者中尤为明显。手术的这种有益效果是减少复发的结果,不仅仅是尽量切除肿瘤。因此,尽管肿瘤缩小了75%或更多的患者倾向于存活更长的时间。
另一项研究表明,术后MR成像(1-3天)获得了相似的结果。生存率与更多肿瘤的切除率相关。与没有残余肿瘤的患者相比,具有术后残余的患者的死亡风险几乎高出七倍。术后MR成像在确定手术切除范围方面的准确度比外科医生的估计高三倍。在肿瘤的“复发”中,有80%来自肿瘤残留。
在三个连续的放射治疗肿瘤学组(RTOG)试验中回顾了胶质母细胞瘤手术切除程度与存活率之间的关系。外科切除术的定义是:全部患者中占19%,部分切除中占64%,活检仅占17%。更高的手术切除率与统计学上显着的更长生存期相关。全切除患者的中位生存期为11.3个月,而活检患者的中位生存期仅为6.6个月。研究人员认为,老年患者尝试进行大肿瘤切除术几乎没有益处,尽管与仅进行活检的患者相比,接受切除术的患者始终具有生存优势。
尝试切除的程度取决于手术时患者的状况(例如年龄,肿瘤位置,临床状态),而且身体状况较好的患者通常会带来外科医生尝试进行较大的切除。
除延长生存期外,手术切除肿瘤(或至少“消灭肿瘤”)可使许多患者恢复充实,生活,而无需使用大剂量的皮质类固醇激素来缓解丧失工作能力的症状(图1A-1C)。在多年前进行的一项研究中,肿瘤切除后的肿瘤相关症状有所好转,而与手术相关的新症状并不常见。该结果具有统计学意义。肿瘤的外科手术切除通常还允许患者进行放射治疗和初始化学疗法,在存在大块疾病的情况下难以接受的治疗。这些结果支持手术切除顺利操作允许的较大可能肿瘤。仅对活检肿瘤进行活检或有限切除几乎没有道理。如果手术切除仅限于肿瘤本身,则几乎不会产生新神经功能缺损。

巴罗拥有3T高场强术中磁共振系统,可以更好地指导外科手术,从而好转患者的治疗效果。
放射治疗
随着更好的成像技术的出现,用于治疗脑肿瘤的适当放射治疗门户和剂量已发生了变化。脑肿瘤研究小组(BTSG)首先报道了对照研究,这些研究表明,与仅进行手术的患者相比,全脑放射治疗可提高患者的生存率。其他数据显示,接受5500至6000 cGy的患者比接受5000 cGy或更少的患者活得更长。在先前引用CT的BTCG研究中,85 放疗后没有肿瘤增强的患者比残留肿瘤的患者生存更长。此外,在放射治疗期间肿瘤体积缩小了50%以上的大肿瘤患者的生存期要比肿瘤缩小不到50%或肿瘤实际增加的患者更长。
在BTCG试验中研究了放射门的大小,该试验比较了恶性神经胶质瘤的全脑放射治疗与全脑加局部消退放射线的比较。在任何一组中,存活率均无统计学差异,这表明减小门静脉大小以“增强”放疗至肿瘤体积与全脑照射一样合适。目前的技术通常将门静脉的大小限制为增强造影剂的体积加上整个放疗过程的3 cm边缘(图1D)。然后,与常规术后全脑放疗和卡莫斯汀(BCNU)相比,放疗的分割率(每天两次)或放疗剂米诺咪唑的添加均未赋予生存优势。 一些研究人员认为,在较短的时间间隔内发出较高剂量的放射线,即所谓的“超分割”,可使患者在较短的时间内接受足够的放射线剂量。 一般而言,我们为无法顺利切除的大型恶性神经胶质瘤的老年患者保留了这种放射形式。
局部放射治疗技术包括放射性种子的间质植入(近距离放射治疗)和放射外科手术。据报道,使用 I 临时植入治疗的复发性恶性神经胶质瘤患者可以延长生存期 。BTCG III期试验87-01将新诊断的患者随机分配为(1)术后临时我将种子植入残留的肿瘤床中,然后进行标准的外部束放射疗法加静脉内BCNU或(2)外部放射疗法加BCNU,而不进行种子植入。这项对照试验的目的是确定以近距离放射治疗形式增加60 Gy到外部照射递送的60 Gy的潜在生存价值。到1994年4月,该研究的应计对象为299名患者,该研究已经结束。
对结果的初步审查显示,接受放疗比没有的患者寿命更长,尽管差异并不明显。植入组和非植入组中约有50%的患者接受了再次手术。如果“复发”归因于放射坏死(主要来自种子),则“复发”肿瘤患者在切除后的寿命比复发时已经存在的患者更长(图1E-1L)。两组活检与肿瘤切除的发生率大致相等,因此表明存活率的差异与失败时肿瘤切除的程度无关。该研究的“”评估已经完成,但尚未发表。尽管结果偏向于间隙组织,但它们在统计学上并不显着(p = 0.08)。
巴罗拥有国际前沿的GammaKnife®辐射系统,该设备能以较精确的方式向患有肿瘤的患者提供放射治疗
因此,进行局部放射治疗的另一种技术是放射外科。用伽玛刀或直线加速器进行的放射外科手术合适地治疗了动静脉畸形,小的原发性和转移性脑瘤以及良性脑瘤,如脑膜瘤和听神经瘤。它在神经胶质瘤治疗中的研究用途已在几份报告中提及。一项试验使用辅助放射外科手术作为恶性神经胶质瘤初始治疗的一部分。三十七名患者接受了常规外照射治疗后接受了残余造影剂增强肿瘤(1000至2000 cGy)的放射外科手术。局部复发仍发生,但总生存时间可能更长。七名(19%)患者需要在放射外科手术后5个月的中位时间再手术以切除坏死性肿瘤。
放射外科的一个主要问题(近距离放射疗法确实如此)是选择患者进行治疗时的选择偏向。Curran等。指出,当两个小组都没有实际接受放射外科手术时,符合放射外科手术条件的患者比没有放射外科手术条件的患者寿命更长。另一项研究显示,与外照射相比,放射外科治疗的恶性神经胶质瘤几乎没有其他生存益处。放射外科手术可能会使一小部分肿瘤小,预后良好的患者受益。RTOG正在执行一项与BTCG间质放疗研究相似的随机试验。RTOG 9305将Karnofsky行为状态(KPS)≥60且术后较大直径≤4 cm的术后残余疾病的上膜间恶性神经胶质瘤患者随机分为接受放射外科手术,然后接受外部放射治疗(60 Gy)和BCNU的患者。单独接受放疗和BCNU。
放射疗法的选择包括:
· 使用计算机来精确定位放射治疗到脑肿瘤的确切位置。技术包括强度调制放射疗法和3D保形放射疗法。
· 使用质子(原子的正部分)而不是X射线作为辐射源。这项技术被称为保形质子束治疗,仅在质子束到达肿瘤后才发出辐射,对周围组织造成的损害少于X射线。
· 使用多束辐射进行高度集中的辐射处理。尽管此技术称为立体定向放射疗法(放射外科),但实际上并不涉及传统意义上的外科手术。每束射线并不是特别强大,但是全部射线相遇的点-在脑瘤处-接受很大剂量的辐射以杀死很小面积的肿瘤细胞。
在放射外科中使用不同类型的技术来提供放射线以治疗脑部肿瘤,例如伽玛刀或线性加速器(LINAC)。放射治疗的副作用取决于您接受的放射类型和剂量。放疗期间或放疗后的常见副作用包括疲劳,头痛和头皮刺激。
化疗
化学疗法使用药物杀死肿瘤细胞。化疗药物可以丸剂形式(口服)服用或静脉注射(静脉注射)。化学疗法通常与放射疗法结合使用以治疗神经胶质瘤。较常用于治疗神经胶质瘤的化疗药物是替莫唑胺(Temodar),它是一种药。化疗的副作用取决于您所接受药物的类型和剂量。常见的副作用包括恶心和呕吐,头痛,脱发,发烧和虚弱。某些副作用可以通过药物治疗。
靶向药物治疗
靶向药物治疗集中于癌细胞内存在的特定异常。通过阻止这些异常,靶向药物治疗可导致癌细胞死亡。贝伐单抗(Avastin)是一种用于治疗称为胶质母细胞瘤的脑癌的靶向药物疗法。通过静脉(静脉)给予的这种药物可停止新血管的形成,切断对肿瘤的血液供应并杀死肿瘤细胞。
未来的治疗策略,胶质瘤研究是一个活跃的研究领域。研究人员正在研究将药物输送到脑部肿瘤的新方法,包括将连续或缓慢的化学疗法或靶向药物疗法释放到肿瘤的泵。这种类型的治疗称为对流增强输送(CED)。
另一种疗法使用称为肿瘤治疗场(Optune)的技术向大脑传递电场,这可以帮助阻止癌细胞的增殖。Optune是一种可穿戴的便携式设备,与替莫唑胺联合使用可治疗成人新诊断出的胶质母细胞瘤。
植入式,卡莫司汀植入膜剂(Gliadel)依靠植入的椎间盘向术后残留的肿瘤组织释放化学疗法。在纳米粒子疗法中,具有异常高表面积的粒子将化学疗法通过血脑屏障直接运送到肿瘤。
结论
由于多种原因,原发性脑肿瘤,是神经胶质瘤,对神经外科医生构成了特别困难的挑战。首先,大脑对肿瘤和治疗的反应都是无法估计的。其次,肿瘤细胞本身是不稳定的,并且容易产生对治疗的抗性。了解肿瘤和正常脑细胞生物学的进步有望带来新的治疗方法。然而,合适的治疗可能会继续需要多种治疗方法。
巴罗神经学研究所表示,目前,多形性胶质母细胞瘤和间变性胶质瘤应通过手术切除,放射疗法和化学疗法进行治疗。如果存在大量残留肿瘤或先前切除后复发,则应通过切除和放射疗法治疗低度星形细胞瘤和少突胶质细胞瘤。化学疗法可能可用于治疗间变性性少突胶质细胞瘤。患有这些肿瘤的患者应转入临床试验。只有不断研究,治疗才能取得进展。 |